题目内容
A是有机羧酸盐,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性,其中B的碱性最强.X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同.A与B等物质的量反应生成D和一种气体单质;C受热分解得到Y、D和X;B与C反应生成D和X.E由两种元素组成,式量为83,将E投入X中得到B和气体Z,Z在标准状况下的密度为0.76g?L-1.
(1)A的化学式是 .Y的电子式是 .
(2)X的沸点比同主族同类型物质要高,原因是 .
(3)写出E与足量盐酸反应的化学方程式
(4)写出在D的饱和溶液中不断通Y析出C的离子方程式 .
(5)A的一个重要应用是根据2A→P+H2↑得到P,P溶液中的阴离子通常用CaCl2使之沉淀,当它完全沉淀时,溶液中Ca2+的物质的量浓度至少为 .(沉淀Ksp=2.3×10-9,当溶液中离子浓度≤10-5mol?L-1,即可认为完全沉淀)
(6)实验室常用P与足量HCl反应所得的有机物在浓硫酸条件下共热分解制某还原性气体,设计实验证明分解产物中还原性气体的存在 .
(1)A的化学式是
(2)X的沸点比同主族同类型物质要高,原因是
(3)写出E与足量盐酸反应的化学方程式
(4)写出在D的饱和溶液中不断通Y析出C的离子方程式
(5)A的一个重要应用是根据2A→P+H2↑得到P,P溶液中的阴离子通常用CaCl2使之沉淀,当它完全沉淀时,溶液中Ca2+的物质的量浓度至少为
(6)实验室常用P与足量HCl反应所得的有机物在浓硫酸条件下共热分解制某还原性气体,设计实验证明分解产物中还原性气体的存在
考点:无机物的推断
专题:推断题
分析:已知A是有机羧酸盐,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性.则可推知化合物A、B、C、D均为含有Na元素的碱或强碱弱酸
盐,B的碱性最强,则B为NaOH;X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同,则X、Y应为H2O和CO2;由C受热分解得到Y、D和X;B与C反应生成D和X,可推知C为NaHCO3,D为Na2CO3;即2NaHCO3
Na2CO3+CO2↑+H2O; NaHCO3+NaOH=Na2CO3+H2O;由此可确定X为H2O,Y为CO2;由有机羧酸盐A与NaOH等物质的量反应生成Na2CO3和一种气体单质,可联想到由无水醋酸钠与NaOH加热反应制取甲烷的脱羧反应:CH3COONa+NaOH
Na2CO3+CH4↑,由此迁移可知,A为甲酸钠(HCOONa),与等物质的量NaOH进行脱羧反应生成Na2CO3和氢气:E由两种元素组成,式量为83,将E投入H2O中得到NaOH和气体Z,Z在标准状况下的密度为0.76g?L-1.由计算可知气体Z的相对分子质量是17,则Z为NH3,由该反应:E+H2O→NaOH+NH3↑,可推知E由Na和N两种元素组成,再根据元素化合价可确定E是Na3N,由此可解答问题.
盐,B的碱性最强,则B为NaOH;X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同,则X、Y应为H2O和CO2;由C受热分解得到Y、D和X;B与C反应生成D和X,可推知C为NaHCO3,D为Na2CO3;即2NaHCO3
| ||
| ||
解答:
解:已知A是有机羧酸盐,B、C、D是常见化合物; A、B、C、D焰色反应呈黄色,水溶液均呈碱性.则可推知化合物A、B、C、D均为含有Na元素的碱或强碱弱酸
盐,B的碱性最强,则B为NaOH;X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同,则X、Y应为H2O和CO2;由C受热分解得到Y、D和X;B与C反应生成D和X,可推知C为NaHCO3,D为Na2CO3;即2NaHCO3
Na2CO3+CO2↑+H2O; NaHCO3+NaOH=Na2CO3+H2O;由此可确定X为H2O,Y为CO2;由有机羧酸盐A与NaOH等物质的量反应生成Na2CO3和一种气体单质,可联想到由无水醋酸钠与NaOH加热反应制取甲烷的脱羧反应:CH3COONa+NaOH
Na2CO3+CH4↑,由此迁移可知,A为甲酸钠(HCOONa),与等物质的量NaOH进行脱羧反应生成Na2CO3和氢气:E由两种元素组成,式量为83,将E投入H2O中得到NaOH和气体Z,Z在标准状况下的密度为0.76g?L-1.由计算可知气体Z的相对分子质量是17,则Z为NH3,由该反应:E+H2O→NaOH+NH3↑,可推知E由Na和N两种元素组成,再根据元素化合价可确定E是Na3N;
(1)上述分析可知A的化学式是 HCOONa;Y的电子式是 ,
,
故答案为:HCOONa; ;
;
(2)X巍峨H2O的沸点比同主族同类型物质要高的原因是:水分子间存在氢键,从而使分子间作用力增加,因此有较高的沸点,
故答案为:水分子间存在氢键;
(3)E为Na3N与足量盐酸反应的化学方程式:Na3N+4HCl=3NaOH+NH4Cl,故答案为:Na3N+4HCl═3NaCl+NH4Cl;
(4)D为Na2CO3的饱和溶液中不断通入通Y为CO2,析出C为NaHCO3,反应的离子方程式为:2Na++CO32-+H2O+CO2=2NaHCO3↓,故答案为:2Na++CO32-+H2O+CO2=2NaHCO3↓;
(5)根据2A→P+H2↑得到P,可知,2HCOONa→Na2C2O4+H2↑,P为Na2C2O4,C2O42-+Ca2+=CaC2O4↓,依据Ksp(CaC2O4)=c(Ca2+)?c(C2O42-)=2.3×10-9,可计算出当CaC2O4完全沉淀时,溶液中Ca2+的物质的量浓度至少为c(Ca2+)=
mol/L=2.3×10-4mol/L,
故答案为:2.3×10-4mol?L-1;
(6)实验室Na2C2O4与足量HCl反应可得到H2C2O4,H2C2O4在浓硫酸条件下共热分解生成CO、CO2、H2O ( 即 H2C2O4
CO↑+CO2↑+H2O ).设计证明分解产物中存在还原性气体CO的实验为:将所得气体先通过足量NaOH溶液(或通过盛有固体NaOH的干燥管),再通过澄清石灰水,若无现象,点燃剩余气体,将事先用澄清石灰水润湿过的烧杯倒置在火焰上方,烧杯内壁变浑浊,说明有还原性气体CO的存在,
故答案为:将所得气体先通过足量NaOH溶液,再通过澄清石灰水,无现象,点燃剩余气体,将事先用澄清石灰水润湿过的烧杯倒置在火焰上方,烧杯内壁变浑浊,说明有还原性气体CO的存在.
盐,B的碱性最强,则B为NaOH;X、Y是最常见的氧化物且与人体、生命息息相关,它们的晶体类型相同,则X、Y应为H2O和CO2;由C受热分解得到Y、D和X;B与C反应生成D和X,可推知C为NaHCO3,D为Na2CO3;即2NaHCO3
| ||
| ||
(1)上述分析可知A的化学式是 HCOONa;Y的电子式是
 ,
,故答案为:HCOONa;
 ;
;(2)X巍峨H2O的沸点比同主族同类型物质要高的原因是:水分子间存在氢键,从而使分子间作用力增加,因此有较高的沸点,
故答案为:水分子间存在氢键;
(3)E为Na3N与足量盐酸反应的化学方程式:Na3N+4HCl=3NaOH+NH4Cl,故答案为:Na3N+4HCl═3NaCl+NH4Cl;
(4)D为Na2CO3的饱和溶液中不断通入通Y为CO2,析出C为NaHCO3,反应的离子方程式为:2Na++CO32-+H2O+CO2=2NaHCO3↓,故答案为:2Na++CO32-+H2O+CO2=2NaHCO3↓;
(5)根据2A→P+H2↑得到P,可知,2HCOONa→Na2C2O4+H2↑,P为Na2C2O4,C2O42-+Ca2+=CaC2O4↓,依据Ksp(CaC2O4)=c(Ca2+)?c(C2O42-)=2.3×10-9,可计算出当CaC2O4完全沉淀时,溶液中Ca2+的物质的量浓度至少为c(Ca2+)=
| 2.3×10-9 |
| 10-5 |
故答案为:2.3×10-4mol?L-1;
(6)实验室Na2C2O4与足量HCl反应可得到H2C2O4,H2C2O4在浓硫酸条件下共热分解生成CO、CO2、H2O ( 即 H2C2O4
| 浓硫酸 |
| △ |
故答案为:将所得气体先通过足量NaOH溶液,再通过澄清石灰水,无现象,点燃剩余气体,将事先用澄清石灰水润湿过的烧杯倒置在火焰上方,烧杯内壁变浑浊,说明有还原性气体CO的存在.
点评:本题考查了物质性质和转化关系的分析判断,主要是信息分析应用,反应过程的理解,离子方程式书写沉淀溶解平衡的计算,掌握基础理解题干信息是关键,题目难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
解释下列事实的化学用语正确的是( )
| A、将NH3通入滴有酚酞的水中,溶液变红:NH3+H2O?NH3?H2O?NH4++OH- | ||||
B、铜与浓硫酸共热产生气体:Cu+H2SO4(浓)
| ||||
| C、CH3COONa的水溶液呈碱性:CH3COO-+H2O═CH3COOH+OH- | ||||
| D、用NaOH溶液吸收Cl2:Cl2+2OH-═2Cl-+H2O |
有关如图装置的说法中正确的是( )


| A、氧化剂与还原剂必须直接接触,才能发生反应 |
| B、乙池中电极反应式为NO3-+4H++e-═NO2↑+2H2O |
| C、当铜棒质量减少6.4g时,甲池溶液质量增加6.4g |
| D、当铜棒质量减少6.4g时,向乙池密封管中通入标准状况下1.12L O2,将使气体全部溶于水 |
解释下列事实的方程式正确的是( )
| A、加热可增强纯碱溶液去污力:CO32-+2H2O═H2CO3+2OH- |
| B、用稀硝酸洗涤做过银镜反应的试管:Ag+4H++NO3-═Ag++NO↑++2H2O |
| C、向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2═2CO2+2CaSO4 |
| D、碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:HCO3-+Ca2++OH-═CaCO3↓+H2O |

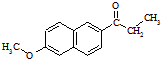 )外,最可能生成的副产物(与G互为同分异构体)的结构简式为
)外,最可能生成的副产物(与G互为同分异构体)的结构简式为 )的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式:
)的衍生物X是C的同分异构体,分子中含有2个取代基,且取代基在同一个苯环上;X在NaOH溶液中完全水解后,含萘环的水解产物的核磁共振氢谱有5个峰.写出X可能的结构简式: 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
