题目内容
4.下列反应属于放热反应的是( )| A. | 氢氧化钡晶体和氯化铵晶体的反应 | |
| B. |  能量变化如图所示的反应 | |
| C. | 燃烧反应和中和反应 | |
| D. | 化学键断裂吸收的热量比化学键生成放出的热量多的反应 |
分析 A.铵盐和碱的反应是吸热反应;
B.放热反应中反应物的总能量大于生成物的总能量;
C.常见的放热反应又:①燃烧反应;②中和反应;③物质的缓慢氧化;④金属与水或酸反应;⑤部分化合反应;
D.放热反应中断键吸收能量小于成键放出能量;吸热反应中断键吸收能量大于成键放出能量.
解答 解:A.氢氧化钡晶体和氯化铵晶体的反应是吸热反应,故A错误;
B.反应物的总能量小于生成物的总能量,为吸热反应,故B错误;
C.燃烧反应和中和反应都属于放热反应,故C正确;
D.化学键断裂吸收的热量比化学键生成放出的热量多的反应,为吸热反应,故D错误;
故选C.
点评 本题考查化学反应中能量变化,题目难度不大,掌握常见的放热反应和吸热反应是解题的关键.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
15.硅及其化合物的应用范围很广,下列说法正确的是( )
| A. | SiO2是酸性氧化物,它不溶于水也不溶于任何酸 | |
| B. | Si+2NaOH+H2O═Na2SiO3+2H2↑,Si为氧化剂 | |
| C. | 硅在地壳中的含量仅次于氧,是应用广泛的半导体材料 | |
| D. | 高温时SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强 |
12.下列实验中,①溶解;②过滤;③蒸发;④配制一定物质的量浓度溶液,均用到的仪器是( )
| A. | 蒸发皿 | B. | 玻璃棒 | C. | 试管 | D. | 分液漏斗 |
16.设阿伏伽德罗常数为NA,则下列说法正确的是( )
| A. | 1.5g甲基(-CH3)所含有的电子数是NA | |
| B. | 14g乙烯和丙烯的混合物中含有原子的数目为NA | |
| C. | 常温常压下,1molCnH2n+2中所含有的共价键数目为(3n+1)NA | |
| D. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4NA |
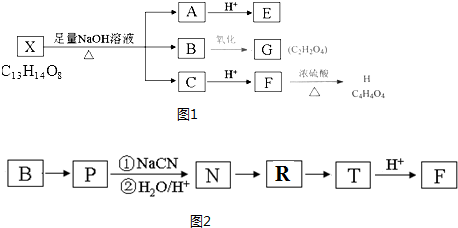
 +(2n-1)H2O.
+(2n-1)H2O. .
.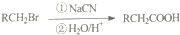
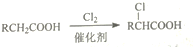

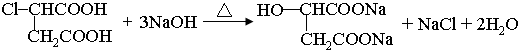 .
.