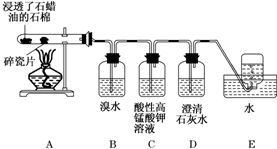
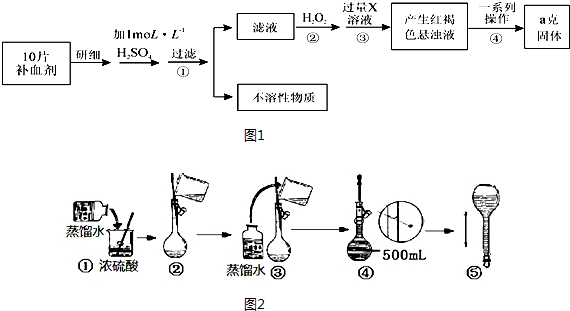
题目内容
14.有机物X的分子式为C13H14O8,如图1是X发生反应的转化关系图及某些物质的信息: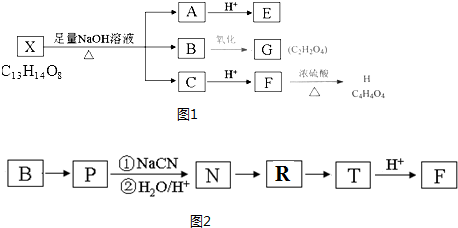
已知:E、F、G、H、X都能与NaHCO3溶液反应生成CO2,且1molG和H分别与足量NaHCO3反应消耗NaHCO3的物质的量相同,其中H无支链且能使溴水褪色,E遇FeCl3溶液显紫色分子内有4种不同环境的氢,且个数比为1:1:2:2.请回答:
(1)有机物B的名称是乙二醇.
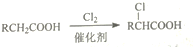
(2)B与G反应可生成高分子化合物M,其化学方程式是n HOOC-COOH+n HOCH2CH2OH$\stackrel{催化剂}{→}$
 +(2n-1)H2O.
+(2n-1)H2O.(3)若X不与Fe3+显紫色,则X可能的结构简式是
 .
.(4)F可作为食品饮料的添加剂,它的聚合物可作为手术缝合线等材料.
已知:I:
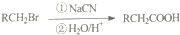
Ⅱ:

由B经过下列途径可合成F(部分条件略),如图2,
N→R的反应类型是取代反应,R→T的化学方程式是
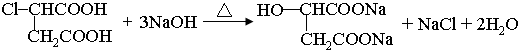 .
.
分析 有机物X的分子式为C13H14O8,在碱性条件下水解得到A、B、C,可推知X中含有酯基,E、F、G、H、X都能与NaHCO3溶液反应生成CO2,均含有羧基,A与酸反应得到E,E遇FeCl3溶液显紫色反应,说明X中含有苯环和酚羟基,结合G、H的分子式可知E分子中碳原子数目为7,分子内有4种不同环境的氢,且个数比为1:1:2:2,则E为 ,A为
,A为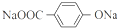 .C与酸化得到F,可知C中含有羧酸形成的钠盐结构,则B为醇.有机物X的不饱和度为(2×13+2-14)÷2=7,可判断X分子含有苯环、两个酯基外,还含有1个双键,1molG和H分别与足量NaHCO3反应消耗NaHCO3的物质的量相同,其中H无支链且能使溴水褪色,G的分子式为C2H2O4,且是B的氧化产物,所以B为HOCH2CH2OH,G为HOOC-COOH,F的结构简式为
.C与酸化得到F,可知C中含有羧酸形成的钠盐结构,则B为醇.有机物X的不饱和度为(2×13+2-14)÷2=7,可判断X分子含有苯环、两个酯基外,还含有1个双键,1molG和H分别与足量NaHCO3反应消耗NaHCO3的物质的量相同,其中H无支链且能使溴水褪色,G的分子式为C2H2O4,且是B的氧化产物,所以B为HOCH2CH2OH,G为HOOC-COOH,F的结构简式为 ,H为HOOCCH=CHCOOH,C为NaOOCCH2CH(OH)COOONa.
,H为HOOCCH=CHCOOH,C为NaOOCCH2CH(OH)COOONa.
若X不与Fe3+显紫色,说明X没有酚羟基,可知X为 .
.
(4)B转化P可以是乙醇发生取代反应生成BrCH2CH2Br,再与NaCN发生取代反应生成NC-CH2CH2-CN,然后水解生成N为HOOC-CH2CH2-COOH,N与氯气发生取代反应生成R为 ,R在氢氧化钠溶液、加热条件下发生水解反应生成T为NaOOCCH2CH(OH)COOONa,最后酸化得到F.
,R在氢氧化钠溶液、加热条件下发生水解反应生成T为NaOOCCH2CH(OH)COOONa,最后酸化得到F.
解答 解:有机物X的分子式为C13H14O8,在碱性条件下水解得到A、B、C,可推知X中含有酯基,E、F、G、H、X都能与NaHCO3溶液反应生成CO2,均含有羧基,A与酸反应得到E,E遇FeCl3溶液显紫色反应,说明X中含有苯环和酚羟基,结合G、H的分子式可知E分子中碳原子数目为7,分子内有4种不同环境的氢,且个数比为1:1:2:2,则E为 ,A为
,A为 .C与酸化得到F,可知C中含有羧酸形成的钠盐结构,则B为醇.有机物X的不饱和度为(2×13+2-14)÷2=7,可判断X分子含有苯环、两个酯基外,还含有1个双键,1molG和H分别与足量NaHCO3反应消耗NaHCO3的物质的量相同,其中H无支链且能使溴水褪色,G的分子式为C2H2O4,且是B的氧化产物,所以B为HOCH2CH2OH,G为HOOC-COOH,F的结构简式为
.C与酸化得到F,可知C中含有羧酸形成的钠盐结构,则B为醇.有机物X的不饱和度为(2×13+2-14)÷2=7,可判断X分子含有苯环、两个酯基外,还含有1个双键,1molG和H分别与足量NaHCO3反应消耗NaHCO3的物质的量相同,其中H无支链且能使溴水褪色,G的分子式为C2H2O4,且是B的氧化产物,所以B为HOCH2CH2OH,G为HOOC-COOH,F的结构简式为 ,H为HOOCCH=CHCOOH,C为NaOOCCH2CH(OH)COOONa.
,H为HOOCCH=CHCOOH,C为NaOOCCH2CH(OH)COOONa.
若X不与Fe3+显紫色,说明X没有酚羟基,可知X为 .
.
(1)有机物B为HOCH2CH2OH,名称是乙二醇,故答案为:乙二醇;
(2)B与G反应可生成高分子化合物M,其化学方程式是:n HOOC-COOH+n HOCH2CH2OH$\stackrel{催化剂}{→}$ +(2n-1)H2O,
+(2n-1)H2O,
故答案为:n HOOC-COOH+n HOCH2CH2OH$\stackrel{催化剂}{→}$ +(2n-1)H2O;
+(2n-1)H2O;
(3)若X不与Fe3+显紫色,由上述分析可知X可能的结构简式是: ,
,
故答案为: ;
;
(4)B转化P可以是乙醇发生取代反应生成BrCH2CH2Br,再与NaCN发生取代反应生成NC-CH2CH2-CN,然后水解生成N为HOOC-CH2CH2-COOH,N与氯气发生取代反应生成R为 ,R在氢氧化钠溶液、加热条件下发生水解反应生成T为NaOOCCH2CH(OH)COOONa,最后酸化得到F.
,R在氢氧化钠溶液、加热条件下发生水解反应生成T为NaOOCCH2CH(OH)COOONa,最后酸化得到F.
N→R的反应类型是:取代反应,R→T的化学方程式是: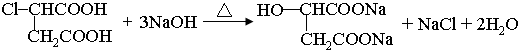 ,
,
故答案为:取代反应;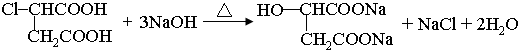 .
.
点评 本题考查有机物的推断与合成,结合有机物的分子式与性质综合分析,需要学生熟练掌握官能团性质与转化,较好的考查学生分析推理能力,难度中等.

| A. | 铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线绞接在一起 | |
| B. | 汽车尾气中含有能污染空气的氮的氧化物,原因是汽油燃烧不充分 | |
| C. | 用新制备的Cu(OH)2悬浊液与病人尿液共热,可检验病人尿液中是否含有葡萄糖 | |
| D. | 某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2 |
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| C. | 同主族元素随原子核电荷数的递增,原子半径依次减小 | |
| D. | ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点降低 |
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
(1)丙物质的化学式为NaH,丁物质中阴离子与阳离子的个数之比为1:2.
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为akJ,试写出表示甲物质燃烧热的热化学方程式CO(g)+$\frac{1}{2}$O2(g)=CO2 (g);△H=-4a kJ/mol.
(3)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为H2O2?H++HO2-.
(4)某同学设计了一个以结构简式是BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图1:

①写出ⅰ中通入该物质这一极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图2所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式2 H2O-4e-=O2↑+4 H+;在t2时所得溶液的pH约为1.
| A. | 加稀盐酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 用分液的方法分离汽油和煤油 | |
| C. | 用溶解、过滤的方法分离KNO3和NaCl固体混合物 | |
| D. | 将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |
| A. | 氢氧化钡晶体和氯化铵晶体的反应 | |
| B. |  能量变化如图所示的反应 | |
| C. | 燃烧反应和中和反应 | |
| D. | 化学键断裂吸收的热量比化学键生成放出的热量多的反应 |