题目内容
17.下列自然资源的开发利用中,不涉及化学变化的是( )| A. | 用蒸馏法从海水中制淡水 | B. | 从铝土矿中制取金属铝 | ||
| C. | 在高温下黏土烧制陶瓷 | D. | 用石油催化裂解制乙烯 |
分析 A.用蒸馏法从海水中制淡水没有新物质生成;
B.从铝土矿中制取金属铝有新物质铝生成;
C.在高温下黏土烧制陶瓷有新物质生成;
D.用石油催化裂解制乙烯有新物质乙烯生成.
解答 解:A.用蒸馏法从海水中制淡水没有新物质生成,属于物理变化,故A正确;
B.从铝土矿中制取金属铝有新物质铝生成,属于化学变化,故B错误;
C.在高温下黏土烧制陶瓷有新物质生成,属于化学变化,故C错误;
D.用石油催化裂解制乙烯有新物质乙烯生成,属于化学变化,故D错误.
故选A.
点评 本考点考查了物理变化和化学变化的区别,基础性比较强,只要抓住关键点:是否有新物质生成,问题就很容易解决.本考点主要出现在选择题和填空题中.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
7. 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
(1)下列措施中既有利于增大反应速率又有利于提高CO转化率的是D.
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
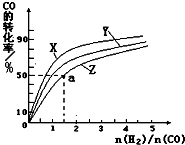
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
①在上述三种温度中,曲线Z对应的温度是270℃
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数 K=4L2•mol-2.
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
若5min~10min只改变了某一条件,所改变的条件是增大H2的浓度;且该条件所改变的量是增大了0.1mol•L-1.
 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1(1)下列措施中既有利于增大反应速率又有利于提高CO转化率的是D.
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
①在上述三种温度中,曲线Z对应的温度是270℃
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数 K=4L2•mol-2.
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
8.实验是化学研究的基础,下列实验装置,试剂选用或惭怍正确的是( )
| A. |  除去CO2中的HCl | B. |  干燥Cl2 | C. |  稀释浓硫酸 | D. |  分离乙醇和水 |
5.常温下,下列各组高于一定能在制定溶液中大量共存的是( )
| A. | pH=14的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 中性溶液中:Fe2+、K+、Cl-、${SO}_{4}^{2-}$ | |
| C. | 含有大量Ba2+的溶液中:Mg2+、Na+、${NO}_{3}^{-}$、Cl- | |
| D. | 由水电离出的c(H+)=1×10-12mol-1的溶液中:Na+、Mg2+、HCO3-、CH3COO- |
2.实验室制Cl2的反应为:Mn02+4HC1(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O,下列有关该反应的说法正确的是( )
| A. | Mn02是还原剂 | B. | HCl被氧化 | ||
| C. | Mn02发生氧化反应 | D. | 4molHCl参加反应则转移4mol电子 |
9.短周期主族元素Q、W、X、Y、Z的原子序数依次增大,它们互不同族,Q的一种同位素常用于文物年代鉴定,X、Y、Z的原子半径逐渐减小,w的单质是最稳定的双原子分子,X与Y质子数之和是W原子核外电子数的4倍.下列说法正确的是:( )
| A. | W的简单气态氰化物比Y的稳定 | |
| B. | XZ2与QY2中含有j的化学键类型相同 | |
| C. | 元素Q、Y的单质均只存在两种同素异形体 | |
| D. | Y的最高价氧化物对应水化物的酸性比Z的强 |
6.设NA表示阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,22g由N2O于CO2组成的混合气体中含有的原子数目为1.5NA | |
| B. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| C. | 0.1mol•L-1的AlCl3溶液中含有的Cl-数目为0.3NA | |
| D. | 标准状况下,11.2L水中含有的分子数目为0.5NA |

 A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中 B与C同周期,D与E、F同周期,A与D 同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中 B与C同周期,D与E、F同周期,A与D 同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.