题目内容
7. 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1(1)下列措施中既有利于增大反应速率又有利于提高CO转化率的是D.
A.随时将CH3OH与反应混合物分离
B.降低反应温度
C.增大体系压强
D.使用高效催化剂
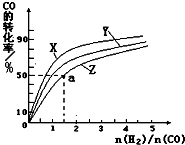
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.请回答:
①在上述三种温度中,曲线Z对应的温度是270℃
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数 K=4L2•mol-2.
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
分析 (1)根据平衡移动原理进行判断,温度升高、压强增大、使用催化剂,反应速率加快,提高CO转化率需要改变条件平衡正向进行;
(2)①合成甲醇的反应是放热反应,温度升高,平衡逆向进行,反应物转化率降低,方向图象曲线变化判断;
②根据一氧化碳的转化率求算各物质的平衡浓度,该反应的平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$,带入计算得到平衡常数;
(3)根据5min和10min时各物质浓度的变化来确定改变条件,反应达到平衡时,根据反应方程式知各物理量之间的关系式知,c(CO)=0.1mol/L-0.04mol/L=0.06mol/L,C(H2)=0.2mol/L-0.08mol/L=0.12mol/L,10min时,c(CO)减小,c(H2)增大,c(CH3OH)增大,则平衡向正反应方向移动,但氢气浓度增大,所以改变的物理量是增大了氢气的浓度.
解答 解:(1)A、随时将CH3OH与反应混合物分离,CH3OH的浓度减小,反应速率降低,故A错误;
B、温度降低,平衡正向进行,但反应速率变小,故B错误;
C、增大体系压强,平衡正向进行,压强增大,反应速率加快,一氧化碳转化率增大,故C正确;
D、使用催化剂,反应速率加快,但平衡不变,不能提高CO转化率,故D错误;
故选D,
故答案为:D;
(2)①根据反应CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1,是放热反应,温度越高,转化率越低,所以曲线Z对应的温度是270℃,
故答案是:270℃;
②CO(g)+2H2(g)?CH3OH(g),该反应的平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$,a点时,CO转化率50%,反应消耗了2mol×50%=1molCO,消耗氢气2mol,剩余1molCO,n(H2)=3mol-2mol=1mol,生成1mol甲醇,a点各组分的浓度是:c(CH3OH)=$\frac{1mol}{2L}$=0.5mol/L,c(CO)=$\frac{1mol}{2L}$=0.5mol/L,c(H2)=$\frac{1mol}{2L}$=0.5mol/L,
带人表达式得:K=$\frac{0.5mol/L}{0.5mol/L×(0.5mol/L)^{2}}$=4L2•mol-2,
故答案是:4L2•mol-2;
(3)反应达到平衡时,根据反应方程式知各物理量之间的关系式知,c(CO)=0.1mol/L-0.04mol/L=0.06mol/L,C(H2)=0.2mol/L-0.08mol/L=0.12mol/L,10min时,c(CO)减小,c(H2)增大,c(CH3OH)增大,则平衡向正反应方向移动,但氢气浓度增大,所以改变的物理量是增大了氢气的浓度,氢气浓度增大了0.2mol/L-0.12mol/L+0.02mol/L=0.1mol/L,
故答案为:增大H2的浓度;增大了0.1 mol•L-1.
点评 本题考查了化学平衡移动原理、盖斯定律、氧化还原反应的配平等知识点,氧化还原反应根据得失电子相等进行配平即可,难点化学平衡移动的分析,要结合浓度该变量来确定改变条件,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 有5.6 g金属被腐蚀 | B. | 有6.5 g金属被氧化 | ||
| C. | 有0.15 mol金属失去电子 | D. | 标准状况下有4.48 L H2逸出 |
(1)用活性炭还原法处理氮氧化物.有关反应为C(s)+2NO(g)?(g)+CO2(g),某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| l0 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.017 | 0.034 |
| 50 | 0.032 | 0.017 | 0.034 |
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”).
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(I)△H=-44.0kJ•mol-1
写出CH4 (g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1.
(3)①取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g)?N2O4(g)△H<0.反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.下列示意图中如图1,可能与实验结果相符的是BD.
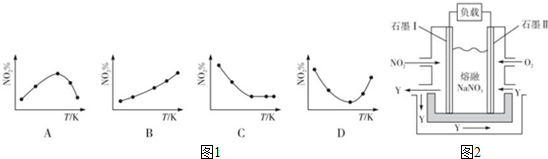
②保持温度、体积不变,向上述平衡体系中再通入一定量的NO2,则达平衡时NO2的转化率增大(填“增大”、“减小”、“不变”或“无法确定”).
③由NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极上发生反应生成一种氧化物Y,其电极反应式NO2+NO3--e-=N2O5.
| A. | 降低温度 | B. | 增大压强 | C. | 充入一定量CO2 | D. | 再加入一些铁粉 |
| A. | 无机物的种类比有机物多 | |
| B. | 互为同系物的有机物有可能同时互为同分异构体 | |
| C. | 丁烷有两种同分异构体 | |
| D. | 醇和醚均互为同分异构体 |
| A. | 用量筒量取浓盐酸配制0.01mol/L稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸 | |
| B. | 配制稀盐酸定容时,俯视容量瓶刻度线 | |
| C. | 滴定前尖嘴处无气泡,滴定终点时有气泡 | |
| D. | 滴定过程中用少量蒸馏水将锥形瓶内避粘附的盐酸冲下 |
| A. | 用蒸馏法从海水中制淡水 | B. | 从铝土矿中制取金属铝 | ||
| C. | 在高温下黏土烧制陶瓷 | D. | 用石油催化裂解制乙烯 |