题目内容
12.氯化钠在日常生活和工业生产中都有广泛应用.
(1)某学生制作了一种家用消毒液发生器,用石墨作电极电解饱和NaCl溶液,装置如图1所示,通电时,为使Cl2被充分吸收,制得有较强杀菌能力的消毒液,该装置中电解α的名称为负极.
(2)氯碱工业中,利用阳离子交换膜(阳离子能通过交换膜,阴离子和气体分子不能通过)电解饱和食盐水以制取的NaOH和氯气的原理如图2所示:
①溶液A的溶质是NaOH.
②电解饱和食盐水的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑.
③图2中阳离子交换膜的作用为既能防止氯气和氢气混合产生爆炸,还可以避免氯气和氢氧化钠之间的反应.
(3)工业上可在调控不同pH的条件下,利用无隔膜电解法获得NaClO3和NaClO,已知在浓食盐水中有效氯(Cl2、HClO、ClO-)浓度分布于pH关系如图3所示:
①已知:2HClO+ClO-=ClO3-+2Cl-+2H+,若欲利用无隔膜电解法制备NaClO3,应控制溶液的pH在7-7.5范围内.制备过程中,向电解液中加入一定量的Na2Cr2O7能起自动调节酸碱度作用,其原理是(用离子方程式表示)Cr2O72-+H2O?2CrO42-+2H+.
②无隔膜电解法制备NaClO时,应控制溶液pH>10,若pH过大,则阳极就有O2生成,其电极反应式为4OH--4e-=O2↑+2H2O.
分析 (1)由装置图可知上端应生成氢气,则a为负极;
(2)用惰性电极电解饱和氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,同时阴极附近还生成氢氧根离子,阳离子交换膜只允许阳离子通过,还可以防止两极产物之间的反应,据此回答判断;
(3)①根据图中氯酸根离子的存在所需的pH来判断即可,在一定条件下,Na2Cr2O7可以和铬酸钠之间相互转化;
②在电解池的阳极上是阴离子失电子的氧化反应,据此回答.
解答 解:(1)用石墨作电极电解饱和氯化钠溶液,若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电解池的下端产生的是氯气,上端产生的是氢气,电解池的阴极上是阳离子氢离子得电子发生得电子的还原反应,生成氢气,在阳极上是阴离子氯离子发生失电子的氧化反应,生成氯气,所以a是负极,b是正极,氯气和氢氧化钠反应的实质是:Cl2+2OH-═Cl-+ClO-+H2O,
故答案为:负;
(2)①用惰性电极电解饱和氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,同时阴极附近还生成氢氧根离子,所以A溶液是NaOH,故答案为:NaOH;
②用惰性电极电解饱和氯化钠溶液时,阳极上氯离子放电、阴极上氢离子放电,同时阴极附近还生成氢氧根离子,电池反应式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑,故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑;
③装置中的阳离子交换膜只能让阳离子通过,不能让阴离子通过,既能防止氯气和氢气混合产生爆炸,还可以避免氯气和氢氧化钠之间的反应,故答案为:既能防止氯气和氢气混合产生爆炸,还可以避免氯气和氢氧化钠之间的反应;
(3)①根据图中氯酸根离子的存在所需的pH知道,若欲利用无隔膜电解法制备NaClO3,应控制溶液的pH在7-7.5;制备过程中,向电解液中加入一定量的Na2Cr2O7,
发生反应:Cr2O72-+H2O?2CrO42-+2H+,起到自动调节酸碱度作用,故答案为:7-7.5;Cr2O72-+H2O?2CrO42-+2H+;
②在电解池的阳极上是阴离子氢氧根离子失电子的氧化反应,即4OH--4e-=O2↑+2H2O,有氧气生成,故答案为:4OH--4e-=O2↑+2H2O.
点评 本题主要考查了电解池的原理的应用,为高频考点,侧重于学生的分析能力的考查,明确发生的电极反应及“使Cl2被完全吸收,制得有较强杀菌能力的消毒液”即可解答,题目难度不大.

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案(1)用活性炭还原法处理氮氧化物.有关反应为C(s)+2NO(g)?(g)+CO2(g),某研究小组向某密闭容器中加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| l0 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.017 | 0.034 |
| 50 | 0.032 | 0.017 | 0.034 |
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H<0(填“>”、“=”或“<”).
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(I)△H=-44.0kJ•mol-1
写出CH4 (g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1.
(3)①取五等份NO2,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:
2NO2(g)?N2O4(g)△H<0.反应相同时间后,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图.下列示意图中如图1,可能与实验结果相符的是BD.
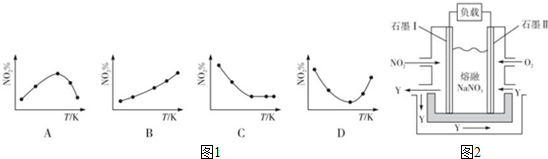
②保持温度、体积不变,向上述平衡体系中再通入一定量的NO2,则达平衡时NO2的转化率增大(填“增大”、“减小”、“不变”或“无法确定”).
③由NO2、O2、熔融NaNO3组成的燃料电池装置如图2所示,在使用过程中石墨I电极上发生反应生成一种氧化物Y,其电极反应式NO2+NO3--e-=N2O5.
(1)写出H2A的第一步电离方程式H2A=H++HA-.
(2)0.1mol/LNaHA溶液中离子浓度从大到小的顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),其中c(H+)>0.01mol/L(填“>”、“=”或“<”),
(3)写出H2A溶液与过量NaOH溶液反应的离子方程式H++HA-+2OH-=A2-+2H2O
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1=4.2×10-7 | HClO | 3×10-8 |
| Ka2=5.6×10-11 |
②25℃时,0.01mol/LNaCN溶液的pH>7;
③在浓度均为0.01mol/L的CH3COONa、NaC10、Na2C03的混合溶液中,逐滴加人0.01mo l/LHCl,则体系中酸根离子反应的先后顺序为CO32-、ClO-、HCO3-、CH3COO-.
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度都会降低,但原理不相同 | |
| B. | 常温下,浓硫酸可以用铁制容器储存,说明铁与冷的浓硫酸不反应 | |
| C. | 向某溶液中加入盐酸酸化的氯化钡溶液,生成白色沉淀,说明原溶液中一定含有SO42- | |
| D. | 向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中一定含有Fe2+ |
| A. | 用食醋除去水垢:${CO}_{3}^{2-}$+2CH3COOH═2CH3COO-+CO2↑+H2O | |
| B. | 用惰性电解电解氯化镁溶液:Mg2++2Cl-$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | |
| C. | 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-═Fe3- | |
| D. | 碳酸氢钠溶液显碱性:${HCO}_{3}^{-}$+H2O?H2CO3+OH- |
| A. | 用蒸馏法从海水中制淡水 | B. | 从铝土矿中制取金属铝 | ||
| C. | 在高温下黏土烧制陶瓷 | D. | 用石油催化裂解制乙烯 |
| A. | 原子半径:r(Y)>r(Z) | |
| B. | X和Z都只能形成一种氧化物 | |
| C. | W的最高价氧化物对应的水化物是强酸 | |
| D. | Y的简单气态氢化物的热稳定性比W的弱 |
| A. | 氧化铜与稀硫酸反应:O2-+2H+═H2O | |
| B. | Na投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 铜与浓硝酸的反应:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 氢氧化钡与稀硫酸的反应:H++2SO42-+2Ba2++OH-═2BaSO4↓+H2O |
| A. | 加热蒸发食盐水可以得到 NaCl 晶体,加热蒸发 AlCl 3 溶液也可以得到 AlCl 3 晶体 | |
| B. | 配制浓度均为 0.1mol•L-1 的H3PO4 和 H2SO4 溶液,分别测其pH,若 H3PO 4溶液的pH大于 H2SO4 溶液的pH,可推出非金属性:S>P | |
| C. | NaHCO3 溶液中滴入酚酞显红色,NaHSO4 溶液中滴入酚酞也显红色 | |
| D. | 钠在氧气中燃烧生成过氧化钠,和钠同主族的锂在氧气中燃烧也生成过氧化锂 |