题目内容
6.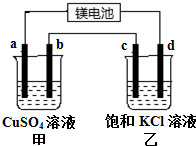 用一种镁二次电池(反应为:xMg+Mo3S4$?_{充电}^{放电}$MgxMo3S4)连接甲、乙装置进行电解.如图所示,a、b、c均为石墨电极,d为Fe电极,电解时d极有气体放出.下列说法不正确的是( )
用一种镁二次电池(反应为:xMg+Mo3S4$?_{充电}^{放电}$MgxMo3S4)连接甲、乙装置进行电解.如图所示,a、b、c均为石墨电极,d为Fe电极,电解时d极有气体放出.下列说法不正确的是( )| A. | 甲装置中a的电极反应为4OH--4e-═O2↑+2H2O | |
| B. | 放电时镁电池正极的电极反应为 Mo3S4+2xe-═Mo3S42x- | |
| C. | 当d极产生0.56 L(标准状况)气体时,b极增重3.2 g | |
| D. | 镁电池放电时,甲池中的SO42-移向a电极 |
分析 与电源正极相连,为阳极,与电源负极相连,为阴极,a、b、c均为石墨电极,d为Fe电极,电解时d极有气体放出,依据电解质溶液为氯化钾的溶液,判断d电极是阴极,d极气体为氢气,2H++2e-=H2↑,d相连的为电源负极,a相连的为电源正极,依据电极原理分析选项.
A.a为电解池阳极,氢氧根离子放电;
B.由总反应式可知,放电时,为原电池反应,Mg化合价升高,被氧化;
C.甲中发生2CuSO4+2H2O $\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,根据得失电子守恒计算;
D.电解池中阴离子移向阳极.
解答 解:A.a、b、c均为石墨电极,d为Fe电极,电解时d极有气体放出,d电极是阴极,惰性电极电解KCl溶液,阳极上是氯离子失电子,2Cl--2e-=Cl2↑,阴极上是氢离子得电子,2H++2e-=H2↑,由两极上的电极反应可以得到总反应为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,d极气体为氢气,d相连的为电源负极,a相连的为电源正极,
a为电解池阳极,发生4OH--4e-=O2↑+2H2O,故A正确;
B.放电时,Mo3S4被还原,为原电池正极反应,发生还原反应,电极反应式为Mo3S4+2xe-═Mo3S42x-,故B正确;
C. d极气体为氢气,2H++2e-=H2↑,当d极产生0.56 L(标准状况)即0.025mol气体时,转移电子数为:0.05mol,甲池中阳极a电极反应:4OH--4e_=2H2O+O2↑;阴极b电极反应为:2Cu2++4e-=2Cu;b极增重0.025mol×64g/mol=1.6g,故C错误;
D.放电时甲池为电解池,电解硫酸铜溶液,SO42-移向阳极,即a电极,故D正确;
故选C.
点评 本题考查了原电池和电解池的工作原理应用,电极判断,电极反应书写,电子转移的计算应用,明确两个烧杯中的电极反应是解答本题的关键,并注意装置特点及电子守恒来解答,题目难度中等.

| A. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 | |
| B. | 饮食“镉大米”会影响骨骼和肾脏,镉元素属于重金属元素 | |
| C. | 使用增塑剂--邻苯二甲酸酯可使聚氯乙烯由弹性塑胶变为硬塑胶 | |
| D. | 面粉生产中禁止添加的过氧化钙(CaO2)中阴阳离子的个数比为1:2 |
| A. | 在100℃、101 kPa条件下,1 mol液态水汽化时需要吸收40.69 kJ的热量,则H2O(g)═H2O(l)的△H=+40.69 kJ•mol-1 | |||||||||
| B. | 已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ•mol-1,则CH4的燃烧热△H=-890.3 kJ | |||||||||
| C. | H2(g)+Br2(g)═2HBr(g)△H=-72 kJ•mol-1其他相关数据如表:
| |||||||||
| D. | 已知S(g)+O2(g)═SO2(s)△H1,S(g)+O2(g)═SO2(g)△H2,则△H2<△H1 |
| A. | 结构片段为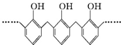 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 | |
| B. | 按系统命名法,有机物(CH3)2CHCH(CH2CH3)CH2CH2CH3命名为:2-甲基-3-乙基庚烷 | |
| C. | 由甘氨酸、丙氨酸形成的二肽有三种 | |
| D. | 乙烯和苯都能使溴水褪色,褪色原理相同 |
| A. | 铁丝在氯气中燃烧:Fe+Cl2$\frac{\underline{\;点燃\;}}{\;}$FeCl2 | |
| B. | 常温下,0.1mol/L醋酸溶液pH≈3 CH3COOH?CH3COO-+H+ | |
| C. | 铝片放入氢氧化钠溶液中有气体产生 2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| D. | 蔗糖与浓硫酸混合产生刺激性气味的气体 C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O |
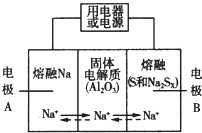 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS ( 3<x<5 )
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下
B.100℃~300℃
C.300℃~350℃
D.350℃~2050℃
(2)关于钠硫电池,下列说法正确的是AD(选填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.充电时,电极A应连接电源的正极
D.充电时电极B的电极反应式为SX2--2e-=xS
(3)25℃时,若用钠硫电池作为电源电解500mL 0.2mol•L-1NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为0.05mol,两极的反应物的质量差为2.3g(假设电解前两极的反应物的质量相等).
| A. | 夏日的傍晚常常看到万丈霞光穿云而过美不胜收 | |
| B. | 受伤时,在流血的伤口上抹一点FeCl3可以止血 | |
| C. | “尿毒症”患者做血液透析治疗 | |
| D. | 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |

