题目内容
2. 有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.
有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.(1)E元素的名称为锌,该元素基态原子的价电子排布式为3d104s2 .
(2)B与D分别与氢形成最简单氢化物沸点高低顺序为NH3>PH3(用化学式表示);原因NH3分子间存在氢键.
(3)A、B、C三种元素分别与氢形成化合物中的M-M(M代表A、B、C)单键的键能如表:
| 氢化物 | HxA-AHx | HmB-BHm | HnC-CHn |
| 键能(kJ.mol-1 | 346 | 247 | 207 |
(4)D与氯形成的化合物DC15,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,请写出该条件下DC15电离的电离方程式2PCl5=PCl6-+PCl4+;该熔体中阴离子的空间构型为正八面体.
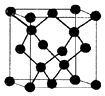
(5)E与C形成的化合物晶体结构有四种,其中一种与金刚石类似,金刚石晶体结构如图所示,该晶体的化学式为ZnO(用元素符号表示);该晶胞的棱长为apm 则该晶体的密度为$\frac{324×1{0}^{30}}{{a}^{3}{N}_{A}}$g/cm3.
分析 有A、B、C、D、E五种原子序数增大的元素,只有一种为金属,A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A,则A、B、C分别是C、N、O元素;B与D同主族,则D为P元素;E为第4周期副族元素,其价层电子为全满,则为Zn元素;
(1)E为Zn元素,其原子核外3d、4s电子为其价电子;
(2)B与D分别与氢形成最简单氢化物分别是NH3和PH3,含有氢键的氢化物熔沸点高于不含氢键的氢化物;
(3)这几种氢化物中每个M原子价层电子对个数都是4,所以其杂化方式相同;排斥力:孤电子对与孤电子对>孤电子对与成键电子对>成键电子对与成键电子对,排斥力越大,形成的化学键越不稳定;
(4)D与氯形成的化合物DC15,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,该阳离子应该为PCl4+,生成的阴离子为PCl6-,利用价层电子对互斥理论判断该阴离子空间构型;
(5)该晶胞中Zn原子个数=4、O原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,根据原子个数比确定化学式;
该晶胞体积=(a×10-10 )3cm3,晶胞密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$.
解答 解:有A、B、C、D、E五种原子序数增大的元素,只有一种为金属,A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A,则A、B、C分别是C、N、O元素;B与D同主族,则D为P元素;E为第4周期副族元素,其价层电子为全满,则为Zn元素;
(1)E为Zn元素,其原子核外3d、4s电子为其价电子,其价电子排布式为3d104s2 ,
故答案为:锌;3d104s2 ;
(2)B与D分别与氢形成最简单氢化物分别是NH3和PH3,含有氢键的氢化物熔沸点高于不含氢键的氢化物,NH3中含有氢键、PH3中不含氢键,所以熔沸点NH3>PH3,
故答案为:NH3>PH3;NH3分子间存在氢键;
(3)这几种氢化物中每个M原子价层电子对个数都是4,所以其杂化方式相同,则杂化方式为一种;排斥力:孤电子对与孤电子对>孤电子对与成键电子对>成键电子对与成键电子对,排斥力越大,形成的化学键越不稳定,乙烷中的碳原子没有孤电子对,肼中的氮原子有1对孤对电子,过氧化氢中的氧原子有两对孤对电子,孤对电子数越多斥力越大,形成的化学键越不稳定,键能越小,
故答案为:1;乙烷中的碳原子没有孤电子对,肼中的氮原子有1对孤对电子,过氧化氢中的氧原子有两对孤对电子,孤对电子数越多斥力越大,形成的化学键越不稳定,键能越小;
(4)D与氯形成的化合物DC15,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,该阳离子应该为PCl4+,生成的阴离子为PCl6-,其电离方程式为2PCl5=PCl6-+PCl4+,
该阴离子中P原子价层电子对个数=6+$\frac{5+1-6×1}{2}$=6,所以为正八面体;
故答案为:2PCl5=PCl6-+PCl4+;正八面体;
(5)该晶胞中Zn原子个数=4、O原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,根据原子个数比确定化学式为ZnO;
该晶胞体积=(a×10-10 )3cm3,晶胞密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{81}{{N}_{A}}×4}{(a×1{0}^{-10})^{3}}$g/cm3=$\frac{324×1{0}^{30}}{{a}^{3}{N}_{A}}$g/cm3,
故答案为:ZnO;$\frac{324×1{0}^{30}}{{a}^{3}{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、微粒空间构型判断、氢键等知识点,侧重考查学生分析、计算及空间想象能力,注意(5)中单位换算,为易错点.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案| A. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| B. | 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA | |
| C. | 1mol的白磷(P4)或四氯化碳(CCl4)中所含的共价健数均为4NA | |
| D. | 工业上电解饱和氯化钠溶液,得到标准状况下22.4L氢气时,转移的电子数为2NA |
| A. | 酒精 | B. | 醋酸 | C. | 乙醛 | D. | 硝基苯 |
| 族周期 | ⅠA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的化合物是NaOH,酸性最强的化合物是HClO4,呈两性的化合物是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)在B、C、D、E、F、G、H中,原子半径最大的是Na.
(5)写出E的单质的结构式N≡N:
(6)写出BG组成的化合物的形成过程
 :
: 
下列说法正确的是( )
| A. | 气体A是无色有刺激性气味的有毒气体 | |
| B. | X中肯定存在Fe2+、Mg2+、NH4+、SO42- | |
| C. | 沉淀I中加入过量溶液E,沉淀完全溶解 | |
| D. | X中不能确定的阳离子只有A13+ |
| A. | NaOH(NaOH) | B. | NaCl(HCl) | C. | CuCl2 (CuO) | D. | H2SO4 (H2SO4 ) |
| A. | 液氨气化吸热,可用作制冷剂 | B. | 明矾易溶于水,可用作净水剂 | ||
| C. | 盐酸具有还原性,可用于除去铁锈 | D. | 浓硝酸其有酸性,可用于钝化铁、铝 |
(1)CO和H2在高温、高压、催化剂条件下反应可制备甲醇.根据下表中相关化学键键能(键能是断裂1mol化学键时需要吸收的能量,或形成1mol化学键时释放的能量)数据,写出CO(CO分子中含有C=O)和H2反应生成甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(g)△H=-105kJ•mol-1.
| 化学键 | H-H | O-H | C-H | C-O | C=O |
| 键能/KJ•mol-1 | 436 | 463 | 413 | 351 | 1076 |
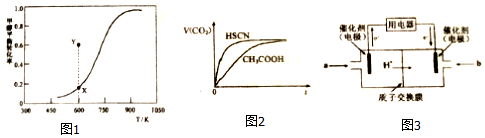
①该脱氢反应的△H>0(填“>”、“<”或“=”)
②600K时,Y点甲醇的V(正)<V(逆)(填“>”、“<”或“=”),判断依据是600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆)
③下列叙述不能说明该脱氢反应已经达到平衡状态的是AD.
A.c(CH3OH)=c(HCHO) B.HCHO的体积分数保持不变
C.V正(CH3OH)=V逆(HCHO) D.混合气体平均分子量保持不变
(3)一定条件下,甲醇与一氧化碳反应可以合成乙酸.已知:常温下,弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5;Ka(HSCN)=0.13.
常温下,将20mL0.10mol•L-1CH3COOH溶液和20mL0.10mol•L-1HSCN溶液分别与20mL0.10mol•L-1NaHCO3溶液混合,实验测得产生CO2气体体积V随时间t变化的示意图如图2所示:
①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快,反应结束后所得两溶液中,C(CH3COO-)< c(SCN-)(填“>”、“<”或“=”).
②常温条件下,将amol•L-1的CH3COOH与bmol•L-1Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为$\frac{2b}{a-2b}$×10-7L/mol.
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流.某种甲醇燃料电池工作原理如图3所示,则通入a气体电极的电极反应式为CH3OH-6e-+H2O=CO2+6H+.
 A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下: