题目内容
14. A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:
A、B、C、D、E、F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下:①A的周期序数等于其主族序数;
②B、D原子的L层中都有两个未成对电子;
③E元素原子最外层电子排布式为(n+1)Sn(n+1)Pn-1;
④F原子有四个能层,K、L、M全充满,最外层只有一个电子.
试回答下列问题:
(1)基态E原子中,电子占据的最高能层符号为M,F的价层电子排布式为3d104s1.
(2)B、C、D的电负性由大到小的顺序为O>N>C(用元素符号填写),C与A形成的分子CA3的VSEPR模型为正四面体.
(3)B和D分别与A形成的化合物的稳定性:BA4小于A2D,原因是H2O中共价键的键能高于CH4中共价键的键能或非金属性O大于C,气态氢化物的稳定性H2O大于CH4.
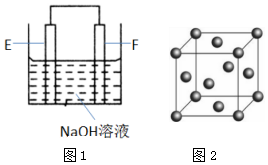
(4)以E、F的单质为电极,组成如图1所示的装置,E极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O.
(5)向盛有F的硫酸盐FSO4的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色溶液,再向深蓝色透明溶液中加入乙醇,析出深蓝色晶体.蓝色沉淀溶解的离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-或Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O.
(6)F的晶胞结构(面心立方)如图2所示:已知两个最近的F的距离为acm,F的密度为$\frac{\sqrt{2}M}{2{N}_{A}{a}^{3}}$g/cm3(阿伏加德罗常数用NA表示,F的相对原子质量用M表示)
分析 ①A的周期序数等于其主族序数,则A为H元素;
②B、D原子的L层中都有两个未成对电子,且B原子序数小于D,则B是C、D是O,则C是N元素;
③E元素原子最外层电子排布式为(n+1)Sn(n+1)Pn-1,n=2,则E为Al元素;
④F原子有四个能层,K、L、M全充满,最外层只有一个电子,则F为Cu元素;
(1)E是Al元素,最高的能层是第三电子层;F是Cu元素,其原子核外3d、4s电子为其价电子;
(2)B、C、D分别是C、N、O元素,同一周期元素,元素电负性随着原子序数增大而增大;
N与H形成的分子NH3,根据价层电子对互斥理论判断氨气的VSEPR构型;
(3)氢化物的稳定性与化学键的键能及非金属的非金属性强弱有关,化学键的键能越大、非金属的非金属性越强,其氢化物越稳定;
(4)Al、Cu和NaOH溶液构成的原电池中,Al易失电子作负极、Cu作正极;
(5)一水合氨和硫酸铜反应生成Cu(OH)2沉淀,氢氧化铜能和氨气反应生成铜铵络离子而使氢氧化铜溶解;
(6)该晶胞中Cu原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个面中心上的原子到顶点的原子距离最小,两个最近的F的距离为acm,则晶胞的棱长=$\sqrt{2}$acm,晶体密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$.
解答 解:①A的周期序数等于其主族序数,则A为H元素;
②B、D原子的L层中都有两个未成对电子,且B原子序数小于D,则B是C、D是O,则C是N元素;
③E元素原子最外层电子排布式为(n+1)Sn(n+1)Pn-1,n=2,则E为Al元素;
④F原子有四个能层,K、L、M全充满,最外层只有一个电子,则F为Cu元素;
(1)E是Al元素,最高的能层是第三电子层,为M层;F是Cu元素,其原子核外3d、4s电子为其价电子,所以其价电子排布式为3d104s1,
故答案为:M;3d104s1;
(2)B、C、D分别是C、N、O元素,同一周期元素,元素电负性随着原子序数增大而增大,所以这三种元素电负性大小顺序是O>N>C;
N与H形成的分子NH3,氨气分子中N共用电子对个数是3、孤电子对数是1,所以N原子价层电子对个数是4,其VSEPR模型是正四面体结构,
故答案为:O>N>C;正四面体;
(3)氢化物的稳定性与化学键的键能及非金属的非金属性强弱有关,化学键的键能越大、非金属的非金属性越强,其氢化物越稳定,H2O中共价键的键能高于CH4中共价键的键能或非金属性O大于C,气态氢化物的稳定性H2O大于CH4,
故答案为:H2O中共价键的键能高于CH4中共价键的键能或非金属性O大于C,气态氢化物的稳定性H2O大于CH4;
(4)Al、Cu和NaOH溶液构成的原电池中,Al易失电子作负极、Cu作正极,负极上Al失电子和氢氧根离子反应生成偏铝酸根离子和水,电极反应式为Al-3e-+4OH-=AlO2-+2H2O,
故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(5)一水合氨和硫酸铜反应生成Cu(OH)2沉淀,氢氧化铜能和氨气反应生成铜铵络离子而使氢氧化铜溶解,则蓝色沉淀溶解离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-或Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-或Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O;
(6)该晶胞中Cu原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,每个面中心上的原子到顶点的原子距离最小,两个最近的F的距离为acm,则晶胞的棱长=$\sqrt{2}$acm,晶体密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{M}{{N}_{A}}×4}{(\sqrt{2}a)^{3}}$g/cm3=$\frac{\sqrt{2}M}{2{N}_{A}{a}^{3}}$g/cm3,
故答案为:$\frac{\sqrt{2}M}{2{N}_{A}{a}^{3}}$.
点评 本题考查物质结构和性质,涉及晶胞计算、配合物、元素周期律、原电池原理等知识点,综合性较强,明确物质结构、化学反应原理、元素周期律等知识点是解本题关键,注意(6)中哪两个原子距离最近是解答该小题的关键,题目难度中等.

| A. | 都是惰性元素 | B. | 化学性质不活泼 | ||
| C. | 都以单原子分子形式存在 | D. | 原子结构均为稳定结构 |
 有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.
有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.(1)E元素的名称为锌,该元素基态原子的价电子排布式为3d104s2 .
(2)B与D分别与氢形成最简单氢化物沸点高低顺序为NH3>PH3(用化学式表示);原因NH3分子间存在氢键.
(3)A、B、C三种元素分别与氢形成化合物中的M-M(M代表A、B、C)单键的键能如表:
| 氢化物 | HxA-AHx | HmB-BHm | HnC-CHn |
| 键能(kJ.mol-1 | 346 | 247 | 207 |
(4)D与氯形成的化合物DC15,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,请写出该条件下DC15电离的电离方程式2PCl5=PCl6-+PCl4+;该熔体中阴离子的空间构型为正八面体.
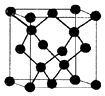
(5)E与C形成的化合物晶体结构有四种,其中一种与金刚石类似,金刚石晶体结构如图所示,该晶体的化学式为ZnO(用元素符号表示);该晶胞的棱长为apm 则该晶体的密度为$\frac{324×1{0}^{30}}{{a}^{3}{N}_{A}}$g/cm3.
| A. |  1,4-二甲基丁烷 1,4-二甲基丁烷 | B. | 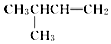 2-甲基-1-丁烯 2-甲基-1-丁烯 | ||
| C. | 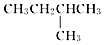 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
| 选项 | 实验及现象 | 结论 |
| A | 向AgNO3和AgCl的浊液中滴入0.1mol/LNa2S溶液,生成黑色沉淀 | Ag2S的溶度积比AgCl的小 |
| B | 将光亮镁条放入盛有NH4Cl溶液的试管中,产生大量气泡,同时将湿润的红色石蕊试纸靠近试管口,试纸变蓝 | 反应产生的气体一定是NH3 |
| C | 向溶液X中先滴加稀硝酸,在滴加Ba(NO3)2溶液,出现白色沉淀 | 溶液X中一定含有SO42- |
| D | 将铜粉加入1.0mol/L Fe2(SO4)3溶液中,溶液变蓝 | 说明氧化性Fe3+>Cu2+ |
| A. | A | B. | B | C. | C | D. | D |
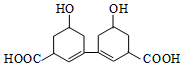 中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )
中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )| A. | 该物质的熔点比同碳的烃分子熔点高 | |
| B. | 分子式为C14H18O4 | |
| C. | 1mol该有机物与足量的金属钠反应产生4molH2 | |
| D. | 环上氢原子的一氯取代物5种 |
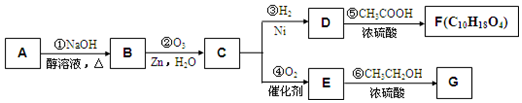
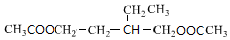 ,E
,E .
.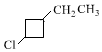 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$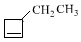 +NaBr+H2O,C→D
+NaBr+H2O,C→D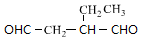 +2H2$\stackrel{催化剂}{→}$
+2H2$\stackrel{催化剂}{→}$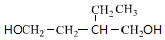 .
.