题目内容
11.下列有关物质的性质与用途具有对应关系的是( )| A. | 液氨气化吸热,可用作制冷剂 | B. | 明矾易溶于水,可用作净水剂 | ||
| C. | 盐酸具有还原性,可用于除去铁锈 | D. | 浓硝酸其有酸性,可用于钝化铁、铝 |
分析 A.液氨气化吸收大量的热,具有制冷作用;
B.明矾溶于水,电离产生的铝离子水解生成具有吸附性氢氧化铝胶体;
C.盐酸与氧化铁反应生成氯化铁和水;
D.依据浓硝酸的强氧化性解答.
解答 解:A.液氨气化吸收大量的热,具有制冷作用,可用作制冷剂,故A正确;
B.明矾溶于水,电离产生的铝离子水解生成具有吸附性氢氧化铝胶体,可以吸附水中固体杂质颗粒而净水,与明矾易溶于水无关,故B错误;
C.盐酸与氧化铁反应生成氯化铁和水,盐酸表现酸性,不表现还原性,故C错误;
D.浓硝酸其有强氧化性,可用于钝化铁、铝,故D错误;
故选:A.
点评 本题考查了元素化合物知识,侧重考查元素化合物性质与用途关系,明确相关物质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
1.2015年10月,屠哟哟获得诺贝尔生理学或医学奖,理由是她发现了青蒿素,这种药品可以有效降低疟疾患者的死亡率.她成为首获科学类诺贝尔奖的中国人.青蒿素两步可合成得到治疗疟疾的药物青蒿琥酯.下列有关说法正确的是( )


| A. | 青蒿素分子式为C15H2405 | |
| B. | 反应②原子利用率为100% | |
| C. | 该过程中青蒿素生成双氢青蒿素属于氧化反应 | |
| D. | 1 mol青蒿琥酯与氢氧化钠溶液反应,最多消耗1 mol氢氧化钠 |
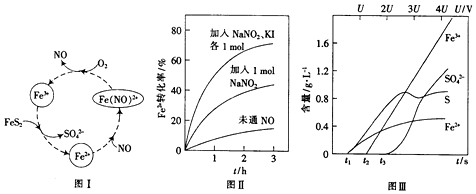
2. 有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.
有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.
(1)E元素的名称为锌,该元素基态原子的价电子排布式为3d104s2 .
(2)B与D分别与氢形成最简单氢化物沸点高低顺序为NH3>PH3(用化学式表示);原因NH3分子间存在氢键.
(3)A、B、C三种元素分别与氢形成化合物中的M-M(M代表A、B、C)单键的键能如表:
上述三种氢化物中,A、B、C元素原子的杂化方式有1种;请解释上表中三种氢化物M-M单键的键能依次下降的原因乙烷中的碳原子没有孤电子对,肼中的氮原子有1对孤对电子,过氧化氢中的氧原子有两对孤对电子,孤对电子数越多斥力越大,形成的化学键越不稳定,键能越小.
(4)D与氯形成的化合物DC15,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,请写出该条件下DC15电离的电离方程式2PCl5=PCl6-+PCl4+;该熔体中阴离子的空间构型为正八面体.
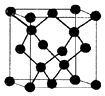
(5)E与C形成的化合物晶体结构有四种,其中一种与金刚石类似,金刚石晶体结构如图所示,该晶体的化学式为ZnO(用元素符号表示);该晶胞的棱长为apm 则该晶体的密度为$\frac{324×1{0}^{30}}{{a}^{3}{N}_{A}}$g/cm3.
 有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.
有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.(1)E元素的名称为锌,该元素基态原子的价电子排布式为3d104s2 .
(2)B与D分别与氢形成最简单氢化物沸点高低顺序为NH3>PH3(用化学式表示);原因NH3分子间存在氢键.
(3)A、B、C三种元素分别与氢形成化合物中的M-M(M代表A、B、C)单键的键能如表:
| 氢化物 | HxA-AHx | HmB-BHm | HnC-CHn |
| 键能(kJ.mol-1 | 346 | 247 | 207 |
(4)D与氯形成的化合物DC15,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,请写出该条件下DC15电离的电离方程式2PCl5=PCl6-+PCl4+;该熔体中阴离子的空间构型为正八面体.
(5)E与C形成的化合物晶体结构有四种,其中一种与金刚石类似,金刚石晶体结构如图所示,该晶体的化学式为ZnO(用元素符号表示);该晶胞的棱长为apm 则该晶体的密度为$\frac{324×1{0}^{30}}{{a}^{3}{N}_{A}}$g/cm3.
19.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. |  1,4-二甲基丁烷 1,4-二甲基丁烷 | B. | 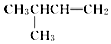 2-甲基-1-丁烯 2-甲基-1-丁烯 | ||
| C. | 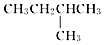 2-甲基丁烷 2-甲基丁烷 | D. | CH2Cl-CH2Cl 二氯乙烷 |
6.下列由实验现象得出的结论正确的是( )
| 选项 | 实验及现象 | 结论 |
| A | 向AgNO3和AgCl的浊液中滴入0.1mol/LNa2S溶液,生成黑色沉淀 | Ag2S的溶度积比AgCl的小 |
| B | 将光亮镁条放入盛有NH4Cl溶液的试管中,产生大量气泡,同时将湿润的红色石蕊试纸靠近试管口,试纸变蓝 | 反应产生的气体一定是NH3 |
| C | 向溶液X中先滴加稀硝酸,在滴加Ba(NO3)2溶液,出现白色沉淀 | 溶液X中一定含有SO42- |
| D | 将铜粉加入1.0mol/L Fe2(SO4)3溶液中,溶液变蓝 | 说明氧化性Fe3+>Cu2+ |
| A. | A | B. | B | C. | C | D. | D |
3.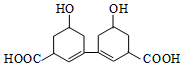 中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )
中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )
 中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )
中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )| A. | 该物质的熔点比同碳的烃分子熔点高 | |
| B. | 分子式为C14H18O4 | |
| C. | 1mol该有机物与足量的金属钠反应产生4molH2 | |
| D. | 环上氢原子的一氯取代物5种 |
20.下列有关化学反应速率的说法正确的是( )
| A. | 用铝片和硫酸反应制氢气,硫酸浓度越高,反应速率越快 | |
| B. | 锌和稀硫酸反应制氢气时,加入少量CuSO4溶液,可加快反应速率 | |
| C. | 增大压强、升高温度和使用催化剂均一定使反应速率加快 | |
| D. | 在碳酸钙和盐酸反应中,加多些碳酸钙可使反应速率明显如快 |
1.如图表示某个化学反应过程的能量变化.该图表明( )


| A. | 催化剂可以改变该反应的热效应 | B. | 该反应是个放热反应 | ||
| C. | 反应物总能量低于生成物 | D. | 化学反应遵循质量守恒定律 |