题目内容
13.下列有机物,不能溶于水的是( )| A. | 酒精 | B. | 醋酸 | C. | 乙醛 | D. | 硝基苯 |
分析 含有羧基或羟基的小分子有机物极易溶于水,卤代烃、酯类、硝基苯等物质都不易溶于水,据此分析解答.
解答 解:A.酒精中含有醇羟基,能和水形成氢键,所以易溶于水,故A不选;
B.醋酸中含有羧基,能和水形成氢键,易溶于水,故B不选;
C.乙醛中含有醛基,能与水形成氢键,易溶于水,故C不选;
D.苯环为憎水基,则硝基苯不溶于水,故D选;
故选D.
点评 本题考查了常见有机物的物理性质,题目难度不大,注意掌握常见有机物的物理性质,熟悉常见的易溶于水和不溶于的有机物.

练习册系列答案
相关题目
2.下列化学用语书写正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 丙烯的键线式: | ||
| C. | 苯的最简式为:CH | D. | 乙醇的结构式: |
3.零族元素难以形成化合物的根本原因是它们( )
| A. | 都是惰性元素 | B. | 化学性质不活泼 | ||
| C. | 都以单原子分子形式存在 | D. | 原子结构均为稳定结构 |
1.2015年10月,屠哟哟获得诺贝尔生理学或医学奖,理由是她发现了青蒿素,这种药品可以有效降低疟疾患者的死亡率.她成为首获科学类诺贝尔奖的中国人.青蒿素两步可合成得到治疗疟疾的药物青蒿琥酯.下列有关说法正确的是( )


| A. | 青蒿素分子式为C15H2405 | |
| B. | 反应②原子利用率为100% | |
| C. | 该过程中青蒿素生成双氢青蒿素属于氧化反应 | |
| D. | 1 mol青蒿琥酯与氢氧化钠溶液反应,最多消耗1 mol氢氧化钠 |
8.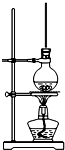 将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
(1)写出该反应的化学方程式C2H5OH+CH3COOH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(2)圆底烧瓶上方长玻璃管的作用是平衡气压,冷凝回流,圆底烧瓶中加的固体物质是沸石或碎瓷片,作用是防止暴沸.
(3)前20min生成酯的厚度比以后每20min要大,原因是开始反应物浓度大,反应速率快.
(4)若每1mm酯的质量均为0.088g,则前40min内乙醇的反应速率为0.00015mol/min.
(5)达到平衡时乙醇(密度0.78g/mL)的转化率为31.5%(保留一位小数).欲提高乙酸的转化率,可采取的措施有分离出乙酸乙酯或增加乙醇的量(写一种即可).
 将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:
将15mL无水酒精、10mL浓硫酸、10mL冰醋酸混合后置于图装置中进行反应,定期测定生成酯的量,数据如表.回答下列问题:| 时间(min) | 20 | 40 | 60 | 80 | 100 | 120 |
| 酯的厚度(mm) | 4 | 6 | 7 | 7.5 | 8 | 8 |
(2)圆底烧瓶上方长玻璃管的作用是平衡气压,冷凝回流,圆底烧瓶中加的固体物质是沸石或碎瓷片,作用是防止暴沸.
(3)前20min生成酯的厚度比以后每20min要大,原因是开始反应物浓度大,反应速率快.
(4)若每1mm酯的质量均为0.088g,则前40min内乙醇的反应速率为0.00015mol/min.
(5)达到平衡时乙醇(密度0.78g/mL)的转化率为31.5%(保留一位小数).欲提高乙酸的转化率,可采取的措施有分离出乙酸乙酯或增加乙醇的量(写一种即可).
18.下列关于苯乙烯(结构简式为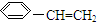 )的叙述错误的是( )
)的叙述错误的是( )
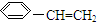 )的叙述错误的是( )
)的叙述错误的是( )| A. | 可以和溴水反应 | |
| B. | 分子中所有原子可能共面 | |
| C. | 是苯的同系物 | |
| D. | 1mol苯乙烯可以和4mol H2发生加成反应 |
2. 有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.
有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.
(1)E元素的名称为锌,该元素基态原子的价电子排布式为3d104s2 .
(2)B与D分别与氢形成最简单氢化物沸点高低顺序为NH3>PH3(用化学式表示);原因NH3分子间存在氢键.
(3)A、B、C三种元素分别与氢形成化合物中的M-M(M代表A、B、C)单键的键能如表:
上述三种氢化物中,A、B、C元素原子的杂化方式有1种;请解释上表中三种氢化物M-M单键的键能依次下降的原因乙烷中的碳原子没有孤电子对,肼中的氮原子有1对孤对电子,过氧化氢中的氧原子有两对孤对电子,孤对电子数越多斥力越大,形成的化学键越不稳定,键能越小.
(4)D与氯形成的化合物DC15,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,请写出该条件下DC15电离的电离方程式2PCl5=PCl6-+PCl4+;该熔体中阴离子的空间构型为正八面体.
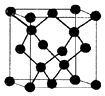
(5)E与C形成的化合物晶体结构有四种,其中一种与金刚石类似,金刚石晶体结构如图所示,该晶体的化学式为ZnO(用元素符号表示);该晶胞的棱长为apm 则该晶体的密度为$\frac{324×1{0}^{30}}{{a}^{3}{N}_{A}}$g/cm3.
 有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.
有A、B、C、D、E五种原子序数增大的元素,只有一种为金属.A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满.(1)E元素的名称为锌,该元素基态原子的价电子排布式为3d104s2 .
(2)B与D分别与氢形成最简单氢化物沸点高低顺序为NH3>PH3(用化学式表示);原因NH3分子间存在氢键.
(3)A、B、C三种元素分别与氢形成化合物中的M-M(M代表A、B、C)单键的键能如表:
| 氢化物 | HxA-AHx | HmB-BHm | HnC-CHn |
| 键能(kJ.mol-1 | 346 | 247 | 207 |
(4)D与氯形成的化合物DC15,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,请写出该条件下DC15电离的电离方程式2PCl5=PCl6-+PCl4+;该熔体中阴离子的空间构型为正八面体.
(5)E与C形成的化合物晶体结构有四种,其中一种与金刚石类似,金刚石晶体结构如图所示,该晶体的化学式为ZnO(用元素符号表示);该晶胞的棱长为apm 则该晶体的密度为$\frac{324×1{0}^{30}}{{a}^{3}{N}_{A}}$g/cm3.
3.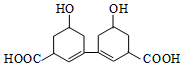 中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )
中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )
 中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )
中国是中草药的发源地,目前中国大约有12000种药用植物.从某中草药提取的有机物结构如图所示,该有机物的下列说法中错误的是( )| A. | 该物质的熔点比同碳的烃分子熔点高 | |
| B. | 分子式为C14H18O4 | |
| C. | 1mol该有机物与足量的金属钠反应产生4molH2 | |
| D. | 环上氢原子的一氯取代物5种 |