题目内容
2.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图: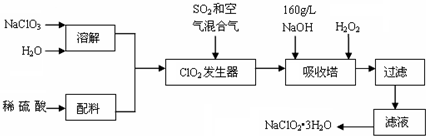
已知:
①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O.
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
③160g/L NaOH溶液是指160gNaOH固体溶于水所得溶液的体积为1L.
(1)160g/L NaOH溶液的物质的量浓度为4mol/L.若要计算该溶液的质量分数,还需要的一个条件是密度 (用文字说明).
(2)发生器中鼓入空气的作用可能是稀释ClO2,防止ClO2分解爆炸(选填序号).
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸; c.将NaClO3氧化成ClO2
(3)发生器内的反应的化学方程式为2NaClO3+SO2═2ClO2+Na2SO4,吸收塔内的反应的化学方程式为2ClO2+2NaOH+H2O2═2NaClO2+O2↑+2H2O.
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是连续检验溶液的pH值.
(5)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是bed (选填序号).
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是重结晶(填操作名称).
分析 ClO2在二氧化硫和空气混合气体中不易分解爆炸,发生器中发生2NaClO3+SO2═2ClO2+Na2SO4,在吸收塔中挤入氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2•3H2O,
(1)浓度g/L表示1L溶液中所含溶质质量的多少.160g/LNaOH溶液表示1L氢氧化钠溶液含有160gNaOH.令溶液体积为1L,计算氢氧化钠的物质的量.利用c=$\frac{n}{V}$计算氢氧化钠溶液的物质的量浓度,结合c=$\frac{1000ρw}{M}$分析;
(2)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全,据此解答;
(3)均发生氧化还原反应,结合反应物、生成物及电子守恒分析;
(4)NaOH溶液显碱性,测定pH可判定;
(5)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,得到的粗晶体经过重结晶可得到纯度更高的晶体.
解答 解:(1)浓度g/L表示1L溶液中所含溶质质量的多少.160g/LNaOH溶液表示1L氢氧化钠溶液含有160gNaOH.令溶液体积为1L,则160gNaOH的物质的量为$\frac{160g}{40g/mol}$=4mol.所以该溶液氢氧化钠的物质的量浓度c(NaOH)=$\frac{4mol}{1L}$=4.00mol/L,若要计算该溶液的质量分数,由c=$\frac{1000ρw}{M}$可知还需要的一个条件是密度,
故答案为:4.00mol/L;密度;
(2)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全,所以发生器中鼓入空气的作用应是稀释ClO2以防止爆炸,
故答案为:稀释ClO2,防止ClO2分解爆炸;
(3)发生器内的反应的化学方程式为2NaClO3+SO2═2ClO2+Na2SO4,吸收塔内的反应的化学方程式为2ClO2+2NaOH+H2O2═2NaClO2+O2↑+2H2O,
故答案为:2NaClO3+SO2═2ClO2+Na2SO4;2ClO2+2NaOH+H2O2═2NaClO2+O2↑+2H2O;
(4)判断NaOH是否过量的简单实验方法是连续检验溶液的pH值,
故答案为:连续检验溶液的pH值;
(5)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.所以操作顺序为bed,要得到更纯的NaClO2•3H2O晶体必须进行的操作是重结晶,
故答案为:bed;重结晶.
点评 本题考查物质的制备实验,为高频考点,把握流程中发生的反应、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意氧化还原反应的应用,题目难度不大.

| A. | “尿毒症”患者做血液透析治疗 | |
| B. | FeCl3溶液中滴入NaOH溶液出现红褐色沉淀 | |
| C. | 在河流入海处易形成沙洲 | |
| D. | 在豆浆中加入盐卤制豆腐 |

| A. | 利用图1装置可定量测定H2O2的分解速率 | |
| B. | 图2中E1表示使用催化剂后的反应热 | |
| C. | 图3表示在平衡体系FeCl3+3KSCN?Fe(SCN)3+3KCl的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象 | |
| D. | 图4表示弱电解质在水中建立电离平衡的过程 |
| A. | 向某溶液中加入AgNO3溶液,可生成白色沉淀,加稀盐酸沉淀不消失,则可确定该溶液中一定含有Cl-, | |
| B. | 用试管加热碳酸氢钠固体时试管口竖直向上 | |
| C. | 实验室需要800mL0.1mol•L-1NaOH溶液,需要称取4.0gNaOH进行配制 | |
| D. | 实验室中可用碱石灰干燥氯气 |
①汽油和氯化钠溶液 ②乙醇与水 ③氯化钠溶液和单质溴,分离以上各混合液的正确方法依次是( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
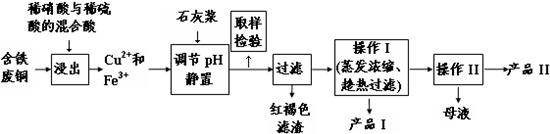
相关物质在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
(1)红褐色滤渣的主要成分是Fe(OH)3(写化学式).
(2)在进行操作I时的最佳温度是100℃.
(3)从溶液中分离出产品Ⅱ的操作Ⅱ应为冷却结晶、过滤、洗涤、干燥.
(4)取样检验步骤中检验的是Fe3+,检验Fe3+最灵敏的试剂是大家熟知的KSCN,可以检验痕量的Fe3+.还可用KI来检验:2Fe3++2I-?2Fe2++I2,有资料认为这可能是一个可逆反应.Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色.为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表.0.1mol/L的FeCl3、KI、KSCN、NaOH、
H2SO4、KMnO4溶液,CCl4,蒸馏水.
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 在试管中加入少量FeCl3溶液和过量 (填少量、过量)的KI溶液. | 深红色如期出现 |
| ② | 将试管中的混合溶液转移至分液漏斗 (填仪器)中,倒入一定量的CCl4, 塞住活塞,充分振荡(萃取),静置. | 液体分层,上层接近无色,下层紫红色 |
| ③ | 打开活塞,先放出下层液体,再从分液漏斗的上口中倒出水层于试管中,加入KSCN溶液 | 出现血红色,则反应后的混合物中含Fe3+,进而证明这的确是一个可逆反应;反之则不含Fe3+,进而证明不是一个可逆反应 |
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g) $\stackrel{催化剂}{?}$ CH3OH(g)△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如右图所示.
①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)

②T1<T2 (填“>”、“<”、“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+).
| A. | 碳酸钡与盐酸反应 2H++BaCO3=Ba2++H2O+CO2↑ | |
| B. | 氢氧化钡溶液与稀硫酸混合 Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| C. | 氯气通入蒸馏水中 Cl2+H2O=Cl-+ClO-+2 H+ | |
| D. | CO2通入过量的澄清石灰水中 CO2+Ca(OH)2=CaCO3↓+H2O |
| A. | Fe | B. | O2 | C. | NaCl | D. | KNO3溶液 |