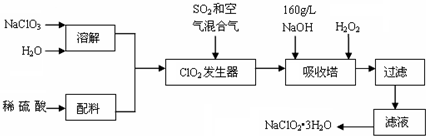
题目内容
20.下列有关实验装置或原理正确的是( )
| A. | 利用图1装置可定量测定H2O2的分解速率 | |
| B. | 图2中E1表示使用催化剂后的反应热 | |
| C. | 图3表示在平衡体系FeCl3+3KSCN?Fe(SCN)3+3KCl的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象 | |
| D. | 图4表示弱电解质在水中建立电离平衡的过程 |
分析 A.气体可从长颈漏斗逸出,不能测定气体的体积;
B.使用催化剂后需要的活化能减小;
C.氯化钾不影响该化学平衡;
D.弱电解质存在电离平衡,平衡时正逆反应速率相等.
解答 解:A.充分双氧水不能用长颈漏斗,应该用分液漏斗,否则无法可知加入双氧水的量,且生成的氧气会从长颈漏斗中流出,故A错误;
B.图2中E1需要能量较高,说明没有使用催化剂,应该是E2使用催化剂后的反应热,故B错误;
C.反应FeCl3+3KSCN?Fe(SCN)3+3KCl的实质为铁离子与硫氰根离子的反应,加入KCl不影响平衡,故C错误;
D.弱电解质存在电离平衡,平衡时正逆反应速率相等,图象符合电离特点,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,明确常见化学实验基本操作方法为解答关键,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
10.在5mL0.02mol/L某金属氯化物(MCln)溶液中,滴加0.05mol/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为( )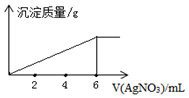

| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
11.某氧原子的质最为ag,12C原子的质量为bg,且NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 该氧原子的摩尔质量为$\frac{12b}{a}$g/mol | B. | 1 mol 该氧原子质量为幽a NAg | ||
| C. | xg 该氧原子所含的电子数为$\frac{16x}{a}$ | D. | yg 该氧原子的中子数一定为$\frac{8y}{a}$ |
8.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)=zC(g),平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3mol/L,下列有关判断正确的是( )
| A. | x+y<z | B. | B的转化率降低 | ||
| C. | 平衡向正反应方向移动 | D. | C的体积分数增大 |
15.在CO2中,Mg燃烧生成MgO和C,下列说法不正确( )
| A. | 在该反应条件下,Mg的还原性强于C的还原性 | |
| B. | Mg、MgO中镁元素微粒的半径:r(Mg2+)<r(Mg) | |
| C. | 元素C 在自然界中既有游离态又有化合态 | |
| D. | 该反应中化学能全部转化为热能 |
5.下列物质必须隔绝空气密封保存的是( )
①Na ②镁条 ③石灰水④NaOH ⑤Na2CO3•10H2O ⑥NaCl.
①Na ②镁条 ③石灰水④NaOH ⑤Na2CO3•10H2O ⑥NaCl.
| A. | ①② | B. | ①③④⑤ | C. | ①②③④ | D. | ①②①②④⑤ |
3.原子结构、元素周期律和元素周期表对于我们化学学习具有理论指导意义,下列有关说法正确的是( )
| A. | 原子的原子核都是由质子和中子构成的,核外电子在原子核外分层运动 | |
| B. | 可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置 | |
| C. | 由氟氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸 | |
| D. | 在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料 |