题目内容
14.甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景.(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g) $\stackrel{催化剂}{?}$ CH3OH(g)△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如右图所示.
①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)

②T1<T2 (填“>”、“<”、“=”),原因是该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=1.6×10-7(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+).
分析 (1)焓变=反应物总键能-生成物总键能;
(2)①a、b两点温度相同,压强不同,压强越大反应速率越大;
②该反应的正反应是放热反应,升高温度CO转化率降低;
③可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
④a点的一氧化碳转化率为50%,总压为0.5MPa,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
而一氧化碳转化率为50%,所以x=0.5mol,分压=总压×物质的量分数;
(3)当有0.5mol甲醇参与反应时,产生的二氧化碳是0.5mol,和0.8mol氢氧化钾反应,根据元素守恒可以计算n (K2CO3)=0.3mol,n (KHCO3)=0.2mol,据此确定离子浓度的大小顺序.
解答 解:(1)反应热=反应物的总键能-生成物的总键能,则△H=2×436+x-343-413×3-465=-99,解得x=1076;
故答案为:1076;
(2)①压强越大反应速率越快,所以a、b两点的反应速率:v(a)<v(b);
故答案为:<;
②该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;
故答案为:<;该反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2;
③a.H2的消耗速率是CH3OH生成速率的2倍均为正反应速率,不能说正逆反应速率相等,故a错误;
b.CH3OH的体积分数随着反应的进行增大,不再改变时化学平衡,故b正确;
c.混合气体的总质量不变,容器可变,则混合气体的体积减小,密度增大,不再改变时化学平衡,故c正确;
d.CO和CH3OH的物质的量之和保持不变,不能说明化学平衡,故d错误;
故答案为:bc;
④a点的一氧化碳转化率为50%,总压为0.5MPa,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
而一氧化碳转化率为50%,所以x=0.5mol,
Kp=$\frac{\frac{0.5}{2}×0.5}{\frac{0.5}{2}×0.5×(\frac{1}{2}×0.5)^{2}}$=1.6×10-7;
故答案为:1.6×10-7;
(3)当有0.5mol甲醇参与反应时,产生的二氧化碳是0.5mol,和0.8mol氢氧化钾反应,设n (K2CO3)=xmol,n (KHCO3)=ymol,根据C、K原子守恒得$\left\{\begin{array}{l}{x+y=0.5}\\{2x+y=0.8}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.3}\\{y=0.2}\end{array}\right.$,
即n (K2CO3)=0.3mol,n (KHCO3)=0.2mol,二者的水溶液均为碱性,且碳酸根离子水解程度大于碳酸氢根离子,但其水解程度都较小,所以c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+),
故答案为:c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+).
点评 本题考查电解原理、化学平衡计算、化学平衡状态判断等知识点,为高频考点,侧重考查学生分析、判断及计算能力,明确化学平衡状态判断方法、外界条件对化学平衡移动影响、盐类水解等知识点是解本题关键,难点是(3)题计算.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案| A. | 该氧原子的摩尔质量为$\frac{12b}{a}$g/mol | B. | 1 mol 该氧原子质量为幽a NAg | ||
| C. | xg 该氧原子所含的电子数为$\frac{16x}{a}$ | D. | yg 该氧原子的中子数一定为$\frac{8y}{a}$ |
在国民生产中有重要意义.以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2L的密闭容器中加入0.2molN2和0.6molH2,在一定条件下发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,若在5分钟时反应达到平衡,此时测得NH3 的物质的量为0.2mol.则前5分钟的平均反应速率v( N2)=0.01mol•L-1•min-1.
(2)平衡后,若要提高H2的转化率,可以采取的措施有CD.
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量氮气
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1>K2(填“<”、“>”或“=”):
②下列各项能作为判断该反应达到化学平衡状态的依据是BC(填序号字母)
A.容器内 N2、H2、NH3的物质的量浓度之比为1:3:2B.v正(H2)=3v正(N2 )
C.容器内压强保持不变D.混合气体的密度保持不变
③400℃时,反应2NH3(g)?N2(g)+3H2(g) 的化学平衡常数为2.当测得NH3、N2和H2 物质的量分别为3mol、2mol和1mol时,则该反应的v正>v逆(填“<”、“>”或“=”).
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是C.
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.勒夏特列原理可指导怎样使用有限原料多出产品
C.催化剂的使用是提高产品产率的有效方法
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益.
| A. | 原子的原子核都是由质子和中子构成的,核外电子在原子核外分层运动 | |
| B. | 可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置 | |
| C. | 由氟氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸 | |
| D. | 在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料 |
| A. | 氧化性:Br2>Cl2 | B. | 稳定性:HF>HCl | ||
| C. | 碱性:Mg(OH)2>NaOH | D. | 酸性:H2SiO3>H2SO4 |

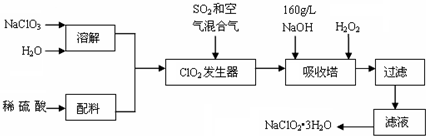

 X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:
X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题: .
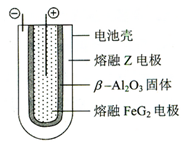
. 2Z+FeG2放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.
2Z+FeG2放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.