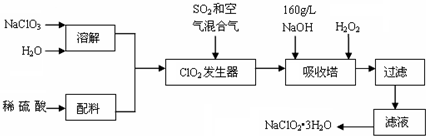
题目内容
7.实验室由含铁废铜为原料生产胆矾(CuSO4•5H2O)和石膏(CaSO4•2H2O)的实验流程如图所示: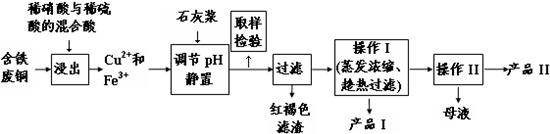
相关物质在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
(1)红褐色滤渣的主要成分是Fe(OH)3(写化学式).
(2)在进行操作I时的最佳温度是100℃.
(3)从溶液中分离出产品Ⅱ的操作Ⅱ应为冷却结晶、过滤、洗涤、干燥.
(4)取样检验步骤中检验的是Fe3+,检验Fe3+最灵敏的试剂是大家熟知的KSCN,可以检验痕量的Fe3+.还可用KI来检验:2Fe3++2I-?2Fe2++I2,有资料认为这可能是一个可逆反应.Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色.为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表.0.1mol/L的FeCl3、KI、KSCN、NaOH、
H2SO4、KMnO4溶液,CCl4,蒸馏水.
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 在试管中加入少量FeCl3溶液和过量 (填少量、过量)的KI溶液. | 深红色如期出现 |
| ② | 将试管中的混合溶液转移至分液漏斗 (填仪器)中,倒入一定量的CCl4, 塞住活塞,充分振荡(萃取),静置. | 液体分层,上层接近无色,下层紫红色 |
| ③ | 打开活塞,先放出下层液体,再从分液漏斗的上口中倒出水层于试管中,加入KSCN溶液 | 出现血红色,则反应后的混合物中含Fe3+,进而证明这的确是一个可逆反应;反之则不含Fe3+,进而证明不是一个可逆反应 |
分析 含铁的废铜为原料加入稀硫酸和稀硝酸的混合溶液,溶解后得到浸出液,在浸出液中主要含有Cu2+、Fe3+、H+、SO42-,加入石灰浆调节溶液PH沉淀铁离子,过滤得到红褐色滤渣为氢氧化铁沉淀,依据石膏和蓝矾的溶解度,控制100°C,滤液中析出石膏,滤液中主要为硫酸铜,通过加热蒸发浓缩,冷却结晶,过滤洗涤,干燥得到硫酸铜晶体;
(1)由工艺流程图转化关系可知,红褐色滤渣的主要成分为氢氧化铁;
(2)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,物质分离较完全,制备的胆矾较纯;
(3)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥;
(4)证明2Fe3++2I-?2Fe2++I2是可逆反应,可在FeCl3溶液中加入过量KI溶液,将反应后的液体转移至分液漏斗中加入四氯化碳萃取,如液体分层,上层接近无色,下层紫红色,说明生成I2,再加入KSCN,如深红色如期出现,说明含有Fe3+,为可逆反应,否则不是可逆反应.
解答 解:含铁的废铜为原料加入稀硫酸和稀硝酸的混合溶液,溶解后得到浸出液,在浸出液中主要含有Cu2+、Fe3+、H+、SO42-,加入石灰浆调节溶液PH沉淀铁离子,过滤得到红褐色滤渣为氢氧化铁沉淀,依据石膏和蓝矾的溶解度,控制100°C,滤液中析出石膏,滤液中主要为硫酸铜,通过加热蒸发浓缩,冷却结晶,过滤洗涤,干燥得到硫酸铜晶体;
(1)由工艺流程图转化关系可知,浸出液中加入石灰浆调节pH值,铁离子转化为Fe(OH)3沉淀析出,红褐色滤渣的主要成分为Fe(OH)3;
故答案为:Fe(OH)3;
(2)由表中溶解度关系可知,胆矾溶解度随温度升高增大,而石膏的溶解度随温度升高降低,所以应控制在较高的温度,温度应该控制在100℃,制备的胆矾相对较纯;
故答案为:100;
(3)从溶液中分离出硫酸铜晶体应为将热溶液冷却结晶、过滤、洗涤、干燥;
故答案为:冷却结晶;洗涤;
(4)证明2Fe3++2I-?2Fe2++I2是可逆反应,可在FeCl3溶液中加入过量KI溶液,将反应后的液体转移至分液漏斗中加入四氯化碳萃取,如液体分层,上层接近无色,下层紫红色,说明生成I2,再加入KSCN,如深红色如期出现,说明含有Fe3+,为可逆反应,否则不是可逆反应,故答案为:
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 过量 | |
| ② | 分液漏斗;CCl4;塞住活塞,充分振荡(萃取),静置 | 液体分层,上层接近无色,下层紫红色 |
| ③ | 打开活塞,先放出下层液体,再从分液漏斗的上口中倒出水层于试管中,加入KSCN溶液 | 出现血红色,则反应后的混合物中含Fe3+,进而证明这的确是一个可逆反应;反之则不含Fe3+,进而证明不是一个可逆反应 |
点评 本题考查学生对工艺流程的理解、阅读题目获取信息能力、物质分离提纯等基本操作、化学平衡影响因素分析恒容平衡移动原理的应用、实验设计等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息、基础知识解决问题的能力.

①Na ②镁条 ③石灰水④NaOH ⑤Na2CO3•10H2O ⑥NaCl.
| A. | ①② | B. | ①③④⑤ | C. | ①②③④ | D. | ①②①②④⑤ |
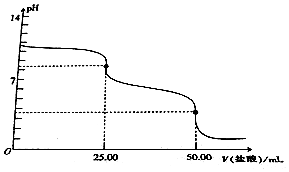
| A. | Na2CO3溶液的浓度为0.2mol•L-1 | |
| B. | 当V(盐酸)=0时,溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| C. | 当V(盐酸)=25.00mL时,溶液中:c(Cl-)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 当V(盐酸)=50.00mL时,溶液中:c(Na+)+c(H+)=c(OH-)+c(Cl-) |