题目内容
11.下列离子方程式正确的是( )| A. | 碳酸钡与盐酸反应 2H++BaCO3=Ba2++H2O+CO2↑ | |
| B. | 氢氧化钡溶液与稀硫酸混合 Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| C. | 氯气通入蒸馏水中 Cl2+H2O=Cl-+ClO-+2 H+ | |
| D. | CO2通入过量的澄清石灰水中 CO2+Ca(OH)2=CaCO3↓+H2O |
分析 A.碳酸钡与盐酸反应生成氯化钡、二氧化碳气体和水;
B.氢离子、氢氧根离子的计量数错误;
C.次氯酸为弱酸,离子方程式中次氯酸不能拆开;
D.氢氧化钙应该写成离子形式.
解答 解:A.碳酸钡与盐酸反应的离子方程式为:2H++BaCO3=Ba2++H2O+CO2↑,故A正确;
B.氢氧化钡与稀硫酸反应生成硫酸钡沉淀和水,正确的离子方程式为:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O,故B错误;
C.氯气通入蒸馏水中,次氯酸不能拆开,正确的离子方程式为:Cl2+H2O=Cl-+HClO+H+,故C错误;
D.CO2通入过量的澄清石灰水中,氢氧化钙不能保留化学式,正确的离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O,故D错误;
故选A.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
8.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)=zC(g),平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3mol/L,下列有关判断正确的是( )
| A. | x+y<z | B. | B的转化率降低 | ||
| C. | 平衡向正反应方向移动 | D. | C的体积分数增大 |
16.用0.1mol•L-1的盐酸滴定25.00mLNa2CO3溶液,其滴定曲线如图所示,下列说法正确的是( )
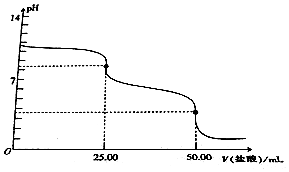

| A. | Na2CO3溶液的浓度为0.2mol•L-1 | |
| B. | 当V(盐酸)=0时,溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| C. | 当V(盐酸)=25.00mL时,溶液中:c(Cl-)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 当V(盐酸)=50.00mL时,溶液中:c(Na+)+c(H+)=c(OH-)+c(Cl-) |
3.原子结构、元素周期律和元素周期表对于我们化学学习具有理论指导意义,下列有关说法正确的是( )
| A. | 原子的原子核都是由质子和中子构成的,核外电子在原子核外分层运动 | |
| B. | 可以根据主族元素原子的电子层数和最外层电子数确定其在周期表中的位置 | |
| C. | 由氟氯两元素在周期表中位置关系推知,氟元素非金属性强于氯元素,所以氢氟酸的酸性应强于盐酸 | |
| D. | 在实际生产中,多在元素周期表的过渡元素区寻找新型半导体材料 |
20.设NA表示阿伏伽德罗常数的值,下列叙述中正确的是( )
| A. | 1molH2O所含有的原子数为NA | |
| B. | 常温常压下,11.2LCl2所含的分子数为0.5NA | |
| C. | 常温常压下,32g O2含有的氧原子数为2NA | |
| D. | 1L0.1mol/LNa2SO4溶液中所含的Na+为0.1NA |
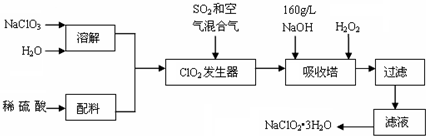

 X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:
X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题: .
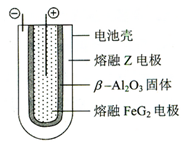
. 2Z+FeG2放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.
2Z+FeG2放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.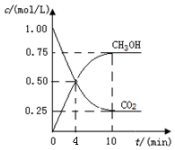 二氧化碳催化加氢合成甲醇的反应:
二氧化碳催化加氢合成甲醇的反应: