题目内容
6.已知等浓度溶液酸性:Al3+>H2CO3>HSO3->NH4+>HCO3-,下列有关反应正确的是( )| A. | 向FeI2溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 将少量CO2通入NH3•H2O中:CO2+2NH3•H2O═(NH4)2CO3+H2O | |
| C. | 将少量SO2通入NH3•H2O中:SO2+2NH3•H2O═(NH4)2SO3+H2O | |
| D. | 将AlCl3与等量Na2CO3溶液混合:3H2O+Al3++CO32-═HCO3-+Al(OH)3+2H+ |
分析 A.氯气少量,氯气只氧化碘离子;
B.由信息可知,少量CO2通入NH3•H2O中,生成碳酸铵和水;
C.少量SO2通入NH3•H2O中,反应生成亚硫酸铵和水;
D.相互促进水解生成氢氧化铝和二氧化碳.
解答 解:A.氯气少量,氯气只氧化碘离子,则离子反应为2I-+Cl2═I2+2Cl-,故A错误;
B.由信息可知,少量CO2通入NH3•H2O中,生成碳酸铵和水,反应为CO2+2NH3•H2O═(NH4)2CO3+H2O,故B正确;
C.少量SO2通入NH3•H2O中,反应生成亚硫酸铵和水,反应为SO2+2NH3•H2O═(NH4)2SO3+H2O,故C正确;
D.相互促进水解生成氢氧化铝和二氧化碳,离子反应为3H2O+2Al3++3CO32-═3CO2↑+2Al(OH)3↓,故D错误;
故选BC.
点评 本题考查离子反应方程式的书写,为高频考点,把握氧化还原反应、与量有关的反应、水解反应为解答的关键,侧重分析与应用能力的考查,注意选项D中铝离子过量对相互促进水解反应无影响,题目难度不大.

练习册系列答案
相关题目
16.下列装置图中的实验方案,能达到实验目的是( )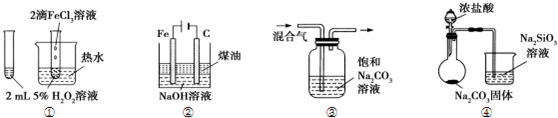

| A. | ①验证FeCl3对H2O2分解反应有催化作用 | |
| B. | ②制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | ③除去CO2气体中混有的SO2 | |
| D. | ④比较HCl、H2CO3和H2SiO3的酸性强弱 |
17.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 在标准状况下,0.5 molNO与0.5 molO2混合后气体分子数为0.75 NA | |
| B. | 某温度下纯水的pH=6,该温度下10 L pH=11的NaOH溶液中含OH-的数目为NA | |
| C. | 0.1molAlCl3完全转化为氢氧化铝胶体,生成O.l NA个胶体粒子 | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2 L |
1.1856年,英国传教士威康臣先生在译著《格物探源》中提到:“天地万物皆以六十四种元质配合而成,如金银铜铁养轻淡炭等皆是元质,皆由微渺而造.”“微渺”即现代之“原子”,下列说法中不正确的是( )
| A. | “元质”即现代之“元素”,现在人类发现的化学元素多于六十四种 | |
| B. | “养、轻、淡”即“氧、氢、氮”三种元素,现代的元素命名更具科学性 | |
| C. | 上文提到的八种“元质”包括四种金属“元质”和四种非金属“元质” | |
| D. | “微渺”因极其微小,故“微渺”是组成物质的基本微粒,不可再分 |
4.某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂.
(1)盛装0.2000mol/L盐酸标准液应该用酸式滴定管.
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化.滴定终点的判断溶液颜色由浅红色变为无色时,且半分钟颜色不变化.
(3)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)
⑤用蒸馏水洗涤玻璃仪器 ⑥滴定操作
正确的操作顺序为:①⑤③④②⑥.
(4)有关数据记录如下:则NaOH溶液的物质的量浓度为0.2000mol/L.
(5)滴定前平视读数,滴定终点时俯视读数,则会使所测碱的浓度值偏低.(填“无影响”、“偏高”或“偏低”).
(1)盛装0.2000mol/L盐酸标准液应该用酸式滴定管.
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视锥形瓶内溶液颜色的变化.滴定终点的判断溶液颜色由浅红色变为无色时,且半分钟颜色不变化.
(3)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)
⑤用蒸馏水洗涤玻璃仪器 ⑥滴定操作
正确的操作顺序为:①⑤③④②⑥.
(4)有关数据记录如下:则NaOH溶液的物质的量浓度为0.2000mol/L.
| 实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.52 |
| 2 | 20.00 | 8.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.38 |
11.下列实验装置能达到实验目的是(夹持仪器未画出)( )
| A. |  用于检验溴丙烷消去产物 | B. |  用于石油的分馏 | ||
| C. |  用于实验室制硝基苯 | D. |  用于实验室制备乙烯 |
8.根据下表中有机物的分子式排布规律,下列判断正确的是( )
| 1 | 2 | 3 | 4 | 5 | 6 |
| CH4O | C2H4O2 | C4H8O2 | C5H12O | C6H12O2 |
| A. | 表格中的有机物1不可能与金属钠反应 | |
| B. | 空格中的有机物的同分异构体数目为3 | |
| C. | 空格中有机物燃烧一定生成CO2和H2O | |
| D. | 表格中2、4、6有机物不可能为同类物质 |
9.下列说法符合事实的是( )
| A. | 2mol浓盐酸与足量MnO2 反应,可以得到0.5mol氯气 | |
| B. | 区别氯化钠溶液和氯化钾溶液,目前我们做不到 | |
| C. | 影响气体体积的主要因素是:分子大小、分子间距、分子数目 | |
| D. | 漂白粉露置空气中变质,既发生氧化反应又发生非氧化还原反应 |