题目内容
9.下列说法符合事实的是( )| A. | 2mol浓盐酸与足量MnO2 反应,可以得到0.5mol氯气 | |
| B. | 区别氯化钠溶液和氯化钾溶液,目前我们做不到 | |
| C. | 影响气体体积的主要因素是:分子大小、分子间距、分子数目 | |
| D. | 漂白粉露置空气中变质,既发生氧化反应又发生非氧化还原反应 |
分析 A.稀盐酸与二氧化锰不反应,所以HCl不能全部反应;
B.焰色反应可以区别钾盐和钠盐;
C.影响气体体积的主要因素是:分子间距、分子数目;
D.漂白精露置空气中变质,先是发生复分解反应生成次氯酸,再是次氯酸分解的过程.
解答 解:A.2mol浓盐酸与足量MnO2 反应,随着反应进行,浓盐酸变为稀盐酸,稀盐酸与二氧化锰不反应,所以HCl不能全部反应,所以生成的氯气小于0.5mol,故A错误;
B.焰色反应可以区别钾盐和钠盐,钾的焰色反应为紫色,钠的焰色反应为黄色,故B错误;
C.相对于分子间的距离,分子的大小可以忽略,所以影响气体体积的主要因素是:分子间距、分子数目,故C错误;
D.漂白精露置空气中变质,先是次氯酸盐和空气成分之间发生复分解反应生成次氯酸,该反应为非氧化还原反应,再是次氯酸分解的过程,该反应是氧化还原反应,故D正确.
故选D.
点评 本题考查了氯气的制备、焰色反应、影响气体体积大小的因素、氧化还原反应,题目涉及的知识点较多,侧重于基础知识的考查,题目难度不大.

练习册系列答案
相关题目
6.已知等浓度溶液酸性:Al3+>H2CO3>HSO3->NH4+>HCO3-,下列有关反应正确的是( )
| A. | 向FeI2溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 将少量CO2通入NH3•H2O中:CO2+2NH3•H2O═(NH4)2CO3+H2O | |
| C. | 将少量SO2通入NH3•H2O中:SO2+2NH3•H2O═(NH4)2SO3+H2O | |
| D. | 将AlCl3与等量Na2CO3溶液混合:3H2O+Al3++CO32-═HCO3-+Al(OH)3+2H+ |
20.在m g 浓度为c mol•L-1,密度为ρ g/cm3的浓硫酸中加入一定量的水,稀释成浓度为c/2mol•L-1的硫酸,则加入水的体积为( )
| A. | 小于m mL | B. | 等于m mL | C. | 大于m mL | D. | 无法确定 |
4.下列关系中一定正确的是( )
| A. | 质子数=核电荷数 | B. | 相对原子质量=质子数+中子数 | ||
| C. | 质子数≠中子数 | D. | 质子数=核外电子数 |
14.下列物质中既含有离子键又含有共价键的是( )
| A. | CO2 | B. | KOH | C. | MgCl2 | D. | Na2O |
1.用NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 常温常压下,17g NH3所含有的原子的数目为4NA | |
| B. | 标准状况下,22.4LCCl4所含分子数为NA | |
| C. | 铝与足量盐酸反应,生成2.24LH2时,转移的电子数为0.2 NA | |
| D. | 0.1 mol/L的Na2CO3溶液中含有Na+的数目是0.2 NA |
18.下列有关化学用语表达不正确的是( )
| A. | 氮气的电子式: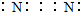 | B. | 次氯酸分子的结构式:H-O-Cl | ||
| C. | Na的原子结构示意图: | D. | 钙离子的电子式:Ca2+ |
19.下列操作不能实现实验目的是( )
| A.目的:浓度对化学反应速率的影响 | B.目的:配制银氨溶液 |
加入 1mol/L 1mL硫酸 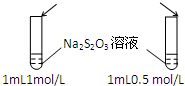 | 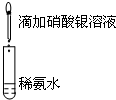 |
| C.目的:比较Al、Fe、Cu活动性 | D.目的:实验室制取氨气 |
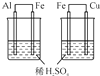 |  |
| A. | A | B. | B | C. | C | D. | D |