题目内容
10.下列有关NaClO和NaCl混合溶液的叙述正确的是( )| A. | 该溶液中,H+、Br-可以大量共存 | |
| B. | 该溶液中,Ag+、K+、CH3CHO可以大量共存 | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
分析 A.NaClO溶液显碱性,且HClO具有强氧化性;
B.离子之间结合生成沉淀,且乙醛易被氧化;
C.滴入少量FeSO4溶液,溶液仍显碱性,离子反应中不能出现氢离子;
D.发生Cl-+ClO-+2H+═Cl2↑+H2O,由反应可知,生成1mol气体转移1mol电子.
解答 解:A.NaClO溶液显碱性,不能大量存在H+,且HClO具有强氧化性,可氧化Br-,故A错误;
B.Ag+、Cl-结合生成沉淀,且乙醛易被氧化,不能共存,故B错误;
C.滴入少量FeSO4溶液,溶液仍显碱性,离子反应中不能出现氢离子,应的离子方程式为2Fe2++ClO-+H2O═Cl-+2Fe3++2OH-,故C错误;
D.发生Cl-+ClO-+2H+═Cl2↑+H2O,由反应可知,生成1mol气体转移1mol电子,则转移电子约为6.02×1023个,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应的离子共存及分析与计算能力的考查,题目难度不大.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
2.在固定容积的密闭容器里,进行合成氨的反应:N2(g)+3H2(g)?2NH3(g),当其他条件不变时,只改变一个反应条件,将合成氨的速率的变化填入空格中.
| 编号 | 改变条件 | 合成氨的速率 |
| ① | 增大N2和H2浓度 | |
| ② | 升高温度 | |
| ③ | 压缩体积 | |
| ④ | 使用铁触媒作催化剂 | |
| ⑤ | 容器体积不变,通入氖气 |
18.下列离子方程式正确的是( )
| A. | 向含有Fe203的悬浊液中通入HI:Fe203+6H+═2Fe3++3H20 | |
| B. | 1mol/L NaAl02 溶液和 1.5 mol/L HCl 溶液等体积混合:6Al02+9H++3H20═5Al(0H)3↓+Al3+ | |
| C. | 向Ca(Cl0)2溶液中通入足量S02:Ca2++2Cl0-+S02+H20═CaS03↓+2HCl0 | |
| D. | 向 0.1mol/L、pH=1的NaHA 溶液中加入NaOH溶液:HA-+0H-═H20+A2- |
5.下列关于焰色反应说法错误的是( )
| A. | 焰色反应属于化学变化 | |
| B. | 做焰色反应实验时可用铂丝或光洁无锈的铁丝 | |
| C. | 焰色反应是元素的性质 | |
| D. | 火焰呈黄色时,样品中可能含有Na+,可能还含有K+ |
15.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘酒中 的碘和酒精 | B. | 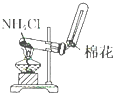 实验室制氧气 | ||
| C. | 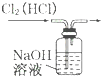 除去Cl2中的HCl | D. | 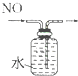 排水集气法收集NO |
2. 工业合成氨反应为:N2(g)+3H2(g)?2NH3(g),对其研究如下:
工业合成氨反应为:N2(g)+3H2(g)?2NH3(g),对其研究如下:
(1)已知H-H键能为436kJ•mol-1,N-H键能为391kJ•mol-1,N≡N键的键能是945.6kJ•mol-1,则上述反应的△H=-92.46kJ•mol-1.
(2)在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
①该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度分别为3mol/L,3mol/L、3mol/L,此时v正大于v逆(填“大于”、“小于”或“等于”)
②由上述表中的实验数据计算得到“浓度~时间”的关系可用图中的曲线表示,表示c(N2)~t的曲线是乙.在此温度下,若起始充入4molN2和12molH2,反应刚达到平衡时,表示c(H2)的曲线上相应的点为B.
 工业合成氨反应为:N2(g)+3H2(g)?2NH3(g),对其研究如下:
工业合成氨反应为:N2(g)+3H2(g)?2NH3(g),对其研究如下:(1)已知H-H键能为436kJ•mol-1,N-H键能为391kJ•mol-1,N≡N键的键能是945.6kJ•mol-1,则上述反应的△H=-92.46kJ•mol-1.
(2)在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
②由上述表中的实验数据计算得到“浓度~时间”的关系可用图中的曲线表示,表示c(N2)~t的曲线是乙.在此温度下,若起始充入4molN2和12molH2,反应刚达到平衡时,表示c(H2)的曲线上相应的点为B.
19.下列有关物质浓度关系的描述中,正确的是( )
| A. | 25℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol•L-1 | |
| B. | 25℃时,向0.1mol•L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) | |
| C. | 0.1mol•L-1的NaHCO3溶液中:c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 同温下,pH相同时,溶液物质的量浓度:c(CH3COONa)>c(NaHCO3)>c(Na2CO3)>c(C6H5ONa) |
20.NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,28 g N2所含电子数为10NA | |
| B. | 46 g钠充分燃烧时转移电子数为2NA | |
| C. | 0.1 mol•L-1NH4Cl溶液中Cl-离子数为0.1NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |