题目内容
9.溶液、胶体与浊液的本质区别是( )| A. | 分散质粒子的大小 | B. | 分散质粒子是否带电荷 | ||
| C. | 能否发生丁达尔现象 | D. | 溶液外观是否均一 |
分析 当分散剂是水或其它溶液时,根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm).
解答 解:当分散剂是水或其它溶液时,根据分散质粒子直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),所以,溶液、胶体和浊液这三种分散系的本质的区别在于分散质粒子直径大小.
故选A.
点评 本题考查学生三类分散系的本质差异知识,属于教材知识的考查,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该物质固体的是( )
| A. | 硝酸铝 | B. | 碳酸氢钠 | C. | 硫酸镁 | D. | 亚硫酸钠 |
20.某反应2C(g)?A(g)+2B(g)△H<0,下列判断正确的是( )
| A. | 任何温度下反应均难以自发进行 | B. | 任何温度下反应均可以自发进行 | ||
| C. | 仅常温下反应可以自发进行 | D. | 仅高温下反应可以自发进行 |
17.NaHS、MgSO4、NaHSO4三种物质组成的混合物中,己知氧元素的质量分数为a%,则其中硫元素的质量分数为( )
| A. | a% | B. | 1-1.75% | C. | 4(l-a%)7 | D. | 3(l-a%)7 |
4.同温、同压下,决定气体体积的主要因素是( )
| A. | 气体分子的直径 | B. | 气体分子间的平均距离 | ||
| C. | 气体的分子数目 | D. | 气体分子的摩尔质量 |
14.将200mL0.1mol•L-1的H2SO4溶液与200mL0.2mol•L-1的H2SO4溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中SO42-浓度是( )
| A. | 0.2mol•L-1 | B. | 0.15mol•L-1 | C. | 0.04mol•L-1 | D. | 0.4mol•L-1 |
7. 氨催化氧化是硝酸工业的基础,按要求回答下列问题:
氨催化氧化是硝酸工业的基础,按要求回答下列问题:
(1)NH3与O2可生成NO,其热化学方程式可表示为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H
已知几种化学键的键能如表:
①由此计算得出△H=12x+5n-4y-12m (用上表中字母表示)kJ•mol-1.
②400℃时,在1L的密闭容器中加入l mol NH3和1.5mol O2,测得平衡时容器的压强为p,且比反应前压强增大了4%,则该温度下NH3的转化率为40%;该反应的平衡常数Kp=3.545×10-3p(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);达到平衡后,保持温度不变,将反应容器的体积增大一倍,平衡向正反应(填“正反应”或“逆反应”)方向移动,判断理由是对气体分子数增大的反应,减小压强平衡向正反应方程移动.
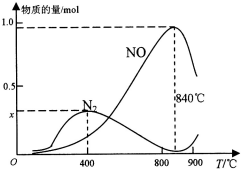
(2)实际反应中,在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,有关温度与各物质的量关系如图所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x=0.3.
②NH3生成NO和N2的反应分别属于放热反应、放热反应(填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水(只答一条即可).
 氨催化氧化是硝酸工业的基础,按要求回答下列问题:
氨催化氧化是硝酸工业的基础,按要求回答下列问题:(1)NH3与O2可生成NO,其热化学方程式可表示为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H
已知几种化学键的键能如表:
| 化学键 | N-H |  | O-H | O=O |
| E/(kJ•mol-1) | x | y | m | n |
②400℃时,在1L的密闭容器中加入l mol NH3和1.5mol O2,测得平衡时容器的压强为p,且比反应前压强增大了4%,则该温度下NH3的转化率为40%;该反应的平衡常数Kp=3.545×10-3p(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);达到平衡后,保持温度不变,将反应容器的体积增大一倍,平衡向正反应(填“正反应”或“逆反应”)方向移动,判断理由是对气体分子数增大的反应,减小压强平衡向正反应方程移动.
(2)实际反应中,在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,有关温度与各物质的量关系如图所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x=0.3.
②NH3生成NO和N2的反应分别属于放热反应、放热反应(填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水(只答一条即可).
5.下列对气体或溶液中的离子鉴定方案正确的是( )
| A. | 向溶液中加入硫酸酸化的NaCl溶液,生成白色沉淀,证明原溶液中含Ag+ | |
| B. | 向溶液中加入稀盐酸,生成使澄清石灰水变浑浊的无色无味气体,则原溶液中含CO32- | |
| C. | 向溶液中加入硝酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中含SO42- | |
| D. | 溶液中加入HCl酸化后,再加入BaCl2溶液,有白色沉淀产生,则溶液中含有SO42- |
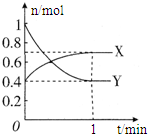 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应: