题目内容
5.下列对气体或溶液中的离子鉴定方案正确的是( )| A. | 向溶液中加入硫酸酸化的NaCl溶液,生成白色沉淀,证明原溶液中含Ag+ | |
| B. | 向溶液中加入稀盐酸,生成使澄清石灰水变浑浊的无色无味气体,则原溶液中含CO32- | |
| C. | 向溶液中加入硝酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中含SO42- | |
| D. | 溶液中加入HCl酸化后,再加入BaCl2溶液,有白色沉淀产生,则溶液中含有SO42- |
分析 A.可生成硫酸钡沉淀;
B.可能含有HCO3-;
C.可能生成AgCl沉淀,也可能含有SO32-;
D.加入HCl酸化后,排除银离子、碳酸根离子等干扰.
解答 解:A.加入硫酸,可生成硫酸钡沉淀,不能确定是否含有银离子,应加入硝酸酸化,故A错误;
B.向溶液中加入盐酸,有使澄清石灰水变浑浊的无色无味的气体放出,可推测溶液中含有CO32-或HCO3-,或二者都存在,故B错误;
C.可能生成AgCl沉淀,也可能含有SO32-,不能确定是否含有SO42-,故C错误;
D.加入HCl酸化后,排除银离子、碳酸根离子等干扰,再加入BaCl2溶液,有白色沉淀产生,则溶液中含有SO42-,故D正确.
故选D.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象和结论为解答的关键,侧重分析与应用能力的考查,注意检验时排除干扰离子,题目难度不大.

练习册系列答案
相关题目
9.溶液、胶体与浊液的本质区别是( )
| A. | 分散质粒子的大小 | B. | 分散质粒子是否带电荷 | ||
| C. | 能否发生丁达尔现象 | D. | 溶液外观是否均一 |
13.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
| A. | 元素X分别与Y、Z、R可以形成多种二元共价化合物 | |
| B. | 元素Y、Z、R形成的化合物的水溶液可能呈酸性、碱性或者中性 | |
| C. | 热稳定性:XmY强于XmR,沸点:XmY高于XmR | |
| D. | 五种元素的单质在常温下有两种是气态、两种是固态、一种是液态 |
20.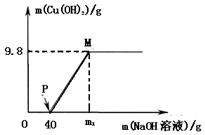 向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )
向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )
 向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )
向含CuCl2和HC1的100g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2则下列说法不正确的是( )| A. | 整个反应过程中,氯离子个数不变 | |
| B. | M点溶液中的溶质有一种 | |
| C. | P点溶液比M点溶液中氯化钠的质量分数大 | |
| D. | 沉沉完全时,m1的数值为120 |
10.已知1.6g某气体所含分子数目约为3.01×1022,此气体摩尔质量为( )
| A. | 32 g | B. | 32 g/mol | C. | 64 mol | D. | 64 g/mol |
17.下列各组物质可用分液漏斗分离的是( )
| A. | 甲苯和水 | B. | 乙酸乙酯和乙醇 | C. | 溴水和酒精 | D. | 苯和硝基苯 |
14.某同学在实验报告中有以下实验数据记录,其中合理的是( )
| A. | 用托盘天平称取11.72g食盐 | |
| B. | 用100mL的量筒量取25.00mL盐酸 | |
| C. | 用pH试纸测得某氯水的pH为4 | |
| D. | 用0.2000 mol/L盐酸滴定20.00mL未知浓度NaOH,用去22.40mL盐酸溶液 |
15.下列各组物质之间的化学反应,反应产物一定为纯净物的是( )
| A. | CH2=CH2+Br2 | B. | CH2=CH-CH2-CH3+HCl | ||
| C. | CH3-CH=CH2+H2O | D. | nCH2=CH-CH3 |