题目内容
7. 氨催化氧化是硝酸工业的基础,按要求回答下列问题:
氨催化氧化是硝酸工业的基础,按要求回答下列问题:(1)NH3与O2可生成NO,其热化学方程式可表示为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H
已知几种化学键的键能如表:
| 化学键 | N-H |  | O-H | O=O |
| E/(kJ•mol-1) | x | y | m | n |
②400℃时,在1L的密闭容器中加入l mol NH3和1.5mol O2,测得平衡时容器的压强为p,且比反应前压强增大了4%,则该温度下NH3的转化率为40%;该反应的平衡常数Kp=3.545×10-3p(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);达到平衡后,保持温度不变,将反应容器的体积增大一倍,平衡向正反应(填“正反应”或“逆反应”)方向移动,判断理由是对气体分子数增大的反应,减小压强平衡向正反应方程移动.
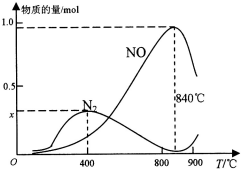
(2)实际反应中,在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,有关温度与各物质的量关系如图所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x=0.3.
②NH3生成NO和N2的反应分别属于放热反应、放热反应(填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水(只答一条即可).
分析 (1)①4NH3(g)+5O2(g)?4NO(g)+6H2O(g),反应的焓变△H=反应物键能总和-生成物的键能总和;
②依据化学平衡的三行式列式计算,气体压强之比等于气体物质的量之比,用平衡分压代替平衡浓度计算平衡常数,分压=总压×物质的量分数,达到平衡后,保持温度不变,将反应容器的体积增大一倍,压强减小平衡向气体体积增大的方向进行;
(2)①在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,结合氮元素守恒计算x;
②氨气和氧气的反应为放热反应,温度高于840℃后,各物质的物质的量发生变化,NO减小,氮气增加,结合化学平衡影响因素分析判断.
解答 解:(1)①4NH3(g)+5O2(g)?4NO(g)+6H2O(g),反应的焓变△H=反应物键能总和-生成物的键能总和=12x+5n-4y-12m,
故答案为:12x+5n-4y-12m;
②400℃时,在1L的密闭容器中加入l mol NH3和1.5mol O2,测得平衡时容器的压强为p,且比反应前压强增大了4%,设达到平衡状态消耗氨气物质的量为x,
4NH3(g)+5O2(g)?4NO(g)+6H2O(g),
起始量(mol) 1 1.5 0 0
变化量(mol) x 1.25x x 1.5x
平衡量(mol) 1-x 1.5-1.25x x 1.5x
(1-x+1.5-1.25x+x+1.5x)=(1+1.5)(1+4%)
x=0.4mol,
则该温度下NH3的转化率=$\frac{0.4mol}{1mol}$×100%=40%,
平衡总物质的量=3.5mol,
用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,该反应的平衡常数Kp=$\frac{(p×\frac{1.5×0.4}{3.5})^{6}(p×\frac{0.4}{3.5})^{4}}{(p×\frac{0.6}{3.5})^{4}(p×\frac{1.5-1.25×0.4}{3.5})^{5}}$=3.545×10-3p,
反应前后气体物质的量增大,达到平衡后,保持温度不变,将反应容器的体积增大一倍,压强减小平衡向正反应方向进行,
故答案为:40%;3.545×10-3p;正反应,对气体分子数增大的反应,减小压强平衡向正反应方程移动;
(2)①在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,结合氮元素守恒计算,5y+6y×2+3y=1
y=0.05
氮气物质的量=6y=0.05mol×6=0.3mol,
x=0.3
故答案为:0.3;
②上述计算分析可知,NH3生成NO和N2的反应分别属于放热反应,温度高于840℃后,各物质的物质的量发生如图所示变化,NO减小,N2物质的量增大,可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水,
故答案为:放热反应,放热反应;可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水.
点评 本题考查了化学平衡影响因素、化学平衡常数的计算、图象比较、数据处理等知识点,掌握基础是解题关键,题目难度中等.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案| A. | Na2SO4=Na2++SO42- | B. | MgCl2=Mg2++Cl- | ||
| C. | HNO3=H++3NO- | D. | Ba(OH)2=Ba2++2OH- |
| A. | 氯化钠用于治疗胃酸过多 | |
| B. | 阿司匹林常用于解热镇痛 | |
| C. | 青霉素是一种常用的抗生素,使用前没有必要进行皮肤敏感实验 | |
| D. | 非处方药都无毒副作用,可长期大量服用 |
| A. | 分散质粒子的大小 | B. | 分散质粒子是否带电荷 | ||
| C. | 能否发生丁达尔现象 | D. | 溶液外观是否均一 |
(1)用CH4催化还原NO,可以消除氮氧化物的污染.已知:
①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
由CH4将NO2完全还原成N2,生成CO2和水蒸气的热化学方程式是CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
(2)NOx也可以被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数K=-9.7×10-4,NO2-的水解常数K=-8.0×10-10,则该温度下水的离子积常数=Ka×Kh(用含Ka、Kb的代数式表示),此时溶液的温度>25℃(填“>”“<”或“=”).
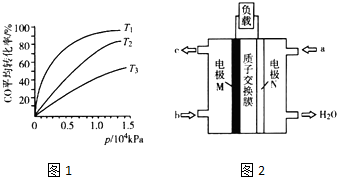
(3)化工上利用CO合成甲醇,反应的热化学方程式为CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1.不同温度下,CO的平衡转化率与压强的关系如图1所示,图中T1、T2、T3的高低顺序是T1<T2<T3,理由是该反应为放热,温度越高,反应物的转化率越低.
(4)化工上还可以利用CH3OH生产CH3OCH3.在体积均为1.0L的恒容密闭容器中发生反应2CH3OH(g)?CH3OCH3(g)+H2O(g).
| 容器换号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH2(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用.已知电池工作时的总反应方程式为2CH3OH+3O2═2CO2+4H2O,电池工作时的示意图如图2所示.质子穿过交换膜移向N电极区(填“M”或“N”),负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.
| A. | 通入稀有气体使压强增大,平衡将正向移动 | |
| B. | X的正反应速率是Y 的逆反应速率的$\frac{m}{n}$倍 | |
| C. | 降低温度,混合气体的平均相对分子质量变小 | |
| D. | 增加X的物质的量,平衡常数增大 |
| A. | 甲苯和水 | B. | 乙酸乙酯和乙醇 | C. | 溴水和酒精 | D. | 苯和硝基苯 |