题目内容
19.在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该物质固体的是( )| A. | 硝酸铝 | B. | 碳酸氢钠 | C. | 硫酸镁 | D. | 亚硫酸钠 |
分析 加热蒸干下列物质的溶液然后灼烧,可以得到该物质的固体,说明该物质在加热过程中性质稳定,不分解,且不发生水解生成其它物质,以此解答该题.
解答 解:A.稀硝酸具有挥发性,且加热易分解,则加热硝酸铝溶液最终不会得到硝酸铝固体,故A错误;
B.NaHCO3不稳定,加热分解生成碳酸钠,故B错误;
C.加热硫酸镁溶液,即使水解,因硫酸难挥发,最终产物应为硫酸镁,故C正确;
D.亚硫酸钠溶液蒸干过程中易被空气中的氧气氧化生成硫酸钠,2Na2SO3+O2=2Na2SO4,蒸干灼烧后得到硫酸钠固体,故D错误;
故选C.
点评 本题考查盐类的水解,综合考查学生化学反应原理的掌握,注意把握盐类水解的原理和应用,该题要注意物质的稳定性,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序下列化学反应先后顺序判断不正确的是( )
| A. | 含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+ | |
| B. | 含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I-、Fe2+、Br- | |
| C. | 含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:Ba(OH)2、KOH、BaCO3、K2CO3 | |
| D. | 含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:OH-、AlO2-、CO32- |
7.下列说法正确的是( )
| A. | 液态HCl、固体NaCl均不导电,所以HCl、NaCl均不是电解质 | |
| B. | SO2的水溶液能导电,所以SO2是电解质 | |
| C. | 蔗糖、酒精在水溶液里和熔融状态时均不导电,所以他们不是电解质 | |
| D. | 铜、石墨均导电,所以它们是电解质 |
11.下列电离方程式正确的是( )
| A. | Na2SO4=Na2++SO42- | B. | MgCl2=Mg2++Cl- | ||
| C. | HNO3=H++3NO- | D. | Ba(OH)2=Ba2++2OH- |
8. 某同学欲用物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填写下列空白:
某同学欲用物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,直到因加入一滴盐酸,溶液由红色变为无色,半分钟不再变色,立即停止滴定.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是DE(填序号).
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
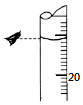
(3)若某次滴定结束时,酸式滴定管中的液面如图所示,则读数为10.20 mL.若仰视,会使读数偏大(填“大”或“小”).
(4)再结合表数据,计算被测氢氧化钠溶液的物质的量浓度是0.1710 mol•L-1.
 某同学欲用物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填写下列空白:
某同学欲用物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填写下列空白:(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,直到因加入一滴盐酸,溶液由红色变为无色,半分钟不再变色,立即停止滴定.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是DE(填序号).
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(3)若某次滴定结束时,酸式滴定管中的液面如图所示,则读数为10.20 mL.若仰视,会使读数偏大(填“大”或“小”).
(4)再结合表数据,计算被测氢氧化钠溶液的物质的量浓度是0.1710 mol•L-1.
| 滴定 次数 | 待测溶液 体积/mL | 标准酸体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 10.00 | 1.34 | 19.39 |
| 第二次 | 10.00 | 4.10 | 21.10 |
| 第三次 | 10.00 | 0.40 | 17.60 |
9.溶液、胶体与浊液的本质区别是( )
| A. | 分散质粒子的大小 | B. | 分散质粒子是否带电荷 | ||
| C. | 能否发生丁达尔现象 | D. | 溶液外观是否均一 |
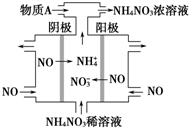 2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:
2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有: