题目内容
14.将200mL0.1mol•L-1的H2SO4溶液与200mL0.2mol•L-1的H2SO4溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中SO42-浓度是( )| A. | 0.2mol•L-1 | B. | 0.15mol•L-1 | C. | 0.04mol•L-1 | D. | 0.4mol•L-1 |
分析 根据混合前后硫酸根离子的总物质的量守恒计算.
解答 解:设混合溶液中SO42-浓度为cmol/L,混合前后硫酸根离子的总物质的量不变,即0.2L×0.1mol•L-1+0.2L×0.2mol•L-1=(0.2L+0.2L)×cmol•L-1,
则c=0.15mol•L-1,故B正确.
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度概念及表达式即可解答,注意混合液中溶质的物质的量不变,试题培养了学生灵活运用基础知识的能力.

练习册系列答案
相关题目
2.下列实验仪器,可用酒精灯直接加热的是( )
①试管 ②量筒 ③蒸发皿 ④烧杯 ⑤容量瓶 ⑥锥形瓶 ⑦燃烧匙 ⑧圆底烧瓶.
①试管 ②量筒 ③蒸发皿 ④烧杯 ⑤容量瓶 ⑥锥形瓶 ⑦燃烧匙 ⑧圆底烧瓶.
| A. | ①③④⑥⑦⑧ | B. | ①③⑦ | C. | ①③④⑤⑥⑧ | D. | ①②③④⑤⑥⑦⑧ |
9.溶液、胶体与浊液的本质区别是( )
| A. | 分散质粒子的大小 | B. | 分散质粒子是否带电荷 | ||
| C. | 能否发生丁达尔现象 | D. | 溶液外观是否均一 |
5.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液).写出该电池的负极反应式:CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充人一定体积的密闭容器中,在两种温度下发生反应:
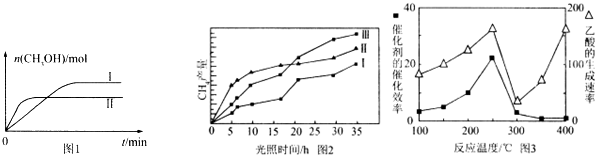 CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1.
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1.
①曲线I、Ⅱ对应的平衡常数大小关系为K1>K2(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.4<n(c)≤1mol.
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图2.在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为II>III>I(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3.
①乙酸的生成速率主要取决于温度影响的范围是300℃~400℃.
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液).写出该电池的负极反应式:CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充人一定体积的密闭容器中,在两种温度下发生反应:
 CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1.
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化见图1.①曲线I、Ⅱ对应的平衡常数大小关系为K1>K2(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、b mol H2、 c mol CH3OH(g)、c mol H2O(g) |
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,在不同催化剂(I、Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化见图2.在0~15小时内,CH4的平均生成速率I、Ⅱ和Ⅲ从大到小的顺序为II>III>I(填序号).
(5)以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3.
①乙酸的生成速率主要取决于温度影响的范围是300℃~400℃.
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
10.已知1.6g某气体所含分子数目约为3.01×1022,此气体摩尔质量为( )
| A. | 32 g | B. | 32 g/mol | C. | 64 mol | D. | 64 g/mol |