题目内容
10.(1)在下列变化中 ①I2升华,②烧碱熔化,③二氧化硅熔化,④NaCl溶于水,⑤HCl溶于水,⑥晶体Ar熔化,⑦Na2O2溶于水,⑧NaHSO4溶于水.未破坏化学键的是①⑥;仅离子键被破坏的是②④;仅共价键被破坏的是③⑤;离子键和共价键同时被破坏的是⑦⑧.(2)试判断:①SiO2,②CO2,③CS2,④KCl晶体的熔点由高到低排列的顺序:①>④>③>②(填相应物质的编号).
分析 (1)①是物理变化,破坏的是分子间作用力.②是离子晶体,破坏的是离子键.③是原子晶体,破坏的是极性键.④是离子化合物,破坏的是离子键.⑤是共价化合物,破坏的是极性键.⑥是分子晶体,破坏的是分子间作用力.⑦是化学变化,破坏的是离子键和非极性键.⑧是离子化合物,破坏的是离子键和极性键;
(2)一般情况下,原子晶体的熔点最高,其次是离子晶体,最小的是分子晶体.对应组成和结构相似的分子晶体,其熔点和分子间作用力大小有关,相对分子质量越大,分子间作用力越强,熔点越高.
解答 解:(1)①是物理变化,破坏的是分子间作用力.②是离子晶体,破坏的是离子键.③是原子晶体,破坏的是极性键.④是离子化合物,破坏的是离子键.⑤是共价化合物,破坏的是极性键.⑥是分子晶体,破坏的是分子间作用力.⑦是化学变化,破坏的是离子键和非极性键.⑧是离子化合物,破坏的是离子键和极性键,则未破坏化学键的是①⑥;仅离子键被破坏的是②④;仅共价键被破坏的是③⑤;离子键和共价键同时被破坏的是⑦⑧,
故答案为:①⑥;②④;③⑤;⑦⑧;
(2)一般情况下,原子晶体的熔点最高,其次是离子晶体,最小的是分子晶体.对应组成和结构相似的分子晶体,其熔点和分子间作用力大小有关,相对分子质量越大,分子间作用力越强,熔点越高,则①SiO2(原子晶体)、②CO2(分子晶体)、③CS2(分子晶体)、④KCl(离子晶体)晶体的熔点由高到低排列的顺序为①>④>③>②,
故答案为:①>④>③>②.
点评 本题考查晶体类型以及化学键的判断,为高频考点,把握化学键的形成及判断的一般规律、不同晶体熔点比较方法为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.依据化学平衡知识,判断下列说法正确的是( )
| A. | 已知NaHA溶液呈碱性,则该溶液中:c(A2-)>c(H2A) | |
| B. | 在小苏打溶液中存在下列关系:c(HCO3-)+c (CO32-)=c(Na+) | |
| C. | 常温下,稀释0.1 mol/L的氨水,水的电离程度减小 | |
| D. | 向AgCl悬浊液中加入足量的NaI,会观察到有黄色沉淀生成 |
5.最近美国宇航局(NASA)马里诺娃博士找到了一种比CO2有效104倍的“超级温室气体”--全氟丙烷(C3F8),并提出用其“温室化火星”,使火星成为第二个地球的计划.有关全氟丙烷的说法正确的是( )
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 全氟丙烷的结构式为 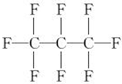 | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 全氟丙烷分子中只有极性键 |
15.已知R2-离子的核内有n个中子,R的质量数为M,则mgR2-离子里含有电子的物质的量为( )
| A. | $\frac{m(M-n)}{M}$ | B. | $\frac{M-n+2}{Mm}$ | C. | $\frac{m(M-n+2)}{M}$ | D. | $\frac{m(M-n-2)}{M}$ |
2.含有共价键的离子化合物是( )
| A. | KCl | B. | HF | C. | NaOH | D. | CaCl2 |
19.研究物质的微观结构,有助于人们理解物质变化的本质.请回答下列问题:
(1)C、Si、N的电负性由大到小的顺序是N>C>Si.C60和金刚石都是碳的同素异形体,二者比较,熔点高的是金刚石.
(2)A、B均为短周期金属元素,依据如表数据,写出B的基态原子的电子排布式1S22S22P63S2.
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关.一般地,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色.如[Co(H2O)6]2+显粉红色.据此判断,[Mn(H2O)6]2+有(填“无”或“有”)颜色.
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等.
①每个COCl2分子内含有3个σ键,1个π键.其中心原子采取SP2杂化轨道方式.
②配合物Fe(CO)5的配体是CO.
(1)C、Si、N的电负性由大到小的顺序是N>C>Si.C60和金刚石都是碳的同素异形体,二者比较,熔点高的是金刚石.
(2)A、B均为短周期金属元素,依据如表数据,写出B的基态原子的电子排布式1S22S22P63S2.
| 电离能 /(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等.
①每个COCl2分子内含有3个σ键,1个π键.其中心原子采取SP2杂化轨道方式.
②配合物Fe(CO)5的配体是CO.
20.2007年诺贝尔化学奖得主 Gerhard Ertl 对金属Pt表面催化CO氧化反应的模型进行了深入研究.下列关于${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的说法正确的是( )
| A. | ${\;}_{78}^{202}$ Pt和${\;}_{78}^{198}$Pt的中子数相同,互称为同位素 | |
| B. | ${\;}_{78}^{202}$ Pt和${\;}_{78}^{198}$Pt的质子数相同,互称为同位素 | |
| C. | ${\;}_{78}^{202}$ Pt和${\;}_{78}^{198}$Pt不能互称为同位素 | |
| D. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt是同一种核素 |
 ; ②Cl2
; ②Cl2 ;③CO2
;③CO2 .
.