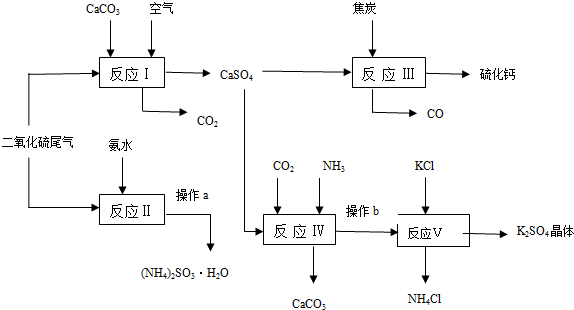
题目内容
5.分析以下几个热化学方程式,哪个是表示固态碳或气态氢气燃烧时的燃烧热的是( )| A. | C (s)+O2(g)=CO (g)△H=-110.5 kJ/mol | |
| B. | C (s)+O 2(g)=CO2(g)△H=-393.5 kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O (l)△H=-571.6 kJ/mol | |
| D. | H2(g)+$\frac{1}{2}$O2(g)=H2O (g)△H=-241.8 kJ/mol |
分析 燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,
A.碳的燃烧为放热反应,焓变应该小于0;
B.根据燃烧热的概念及热化学方程式的书写原则分析;
C.氢气燃烧热的热化学方程式中,氢气的计量数必须为1;
D.氢气的燃烧热中,生成水的状态必须液态.
解答 解:A.C燃烧生成的稳定氧化物是CO2不是CO,且焓变为负值,所以不符合燃烧热的概念要求,故A错误;
B.1molC完全燃烧生成稳定的CO2,符合燃烧热的概念要求,该反应放出的热量为燃烧热,故B正确;
C.燃烧热是指1mol纯净物完全燃烧,方程式中氢气的系数为2mol,不是氢气的燃烧热,故C错误;
D.燃烧热的热化学方程式中生成的氧化物必须为稳定氧化物,水为液态时较稳定,故D错误;
故选B.
点评 本题考查热化学方程式的书写方法,题目难度不大,明确燃烧热达到概念为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
15.莽草酸结构简式如图所示,下列说法不正确的是( )


| A. | 1 mol莽草酸完全燃烧消耗156.8 L O2 | |
| B. | 1 mol莽草酸最多与4 mol Na发生反应 | |
| C. | 莽草酸能使溴的四氯化碳溶液褪色 | |
| D. | 莽草酸可发生聚合反应 |
16.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:K+、NO3-、SO32-、Na+ | |
| B. | 使石蕊呈红色的溶液中:Na+、HCO3-、NO3-、AlO2- | |
| C. | 使pH试纸显红色的溶液中:Cu2+、Fe3+、NO3-、SO42- | |
| D. | 在酸性溶液中:NH4+、Na+、Cu2+、ClO- |
13.在进行钠的性质的实验时,小明同学根据钠所属的物质类别即金属来推测钠可能与初中所学习的铁具有相似的化学性质,小明根据物质所属类别预测物质的性质属于研究物质性质的哪一步( )
| A. | 第一步 | B. | 第二步 | C. | 第三步 | D. | 第四步 |
10.实验室中需要配制2 mol/L的NaCl溶液950 mL,配制时应选用的容量瓶的规格是( )
| A. | 950 mL | B. | 500 mL | C. | 1 000 mL | D. | 任意规格 |
14.TBC的一种标准谱图如图所示,它是( )


| A. | 核磁共振谱 | B. | 质谱 | C. | 红外光谱 | D. | 紫外光谱 |

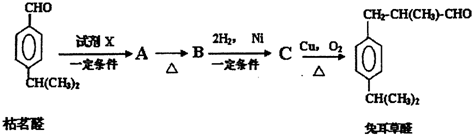

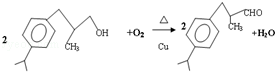 .
. 、
、 .
.