题目内容
 根据反应:mA(g)+nB(g)?pC(g)△H,结合图中所给的信息填空.
根据反应:mA(g)+nB(g)?pC(g)△H,结合图中所给的信息填空.(填“>”、“=”或“<”)
T1
p1
m+n
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:根据“先拐先平,数值大”原则,采取定一议二得到温度和压强的大小关系,根据图示,结合压强和C的含量的关系判断方程式前后的系数和大小关系.
解答:
解:压强相同时,比较温度,即比较曲线T1、P2与曲线T2、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的温度高,所以T1>T2;温度相同时,比较压强,即比较曲线T1、P1与曲线T1、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的压强高,所以P1<P2,
(1)由以上分析可知,T1>T2,故答案为:>;
(2)由以上分析可知,P1<P2,故答案为:<;
(3)压强P1<P2,由图知压强越大,C的含量越高,所以平衡向正反应进行,增大压强,平衡向体积减小的方向移动,所以m+n>q,故答案为:>.
(1)由以上分析可知,T1>T2,故答案为:>;
(2)由以上分析可知,P1<P2,故答案为:<;
(3)压强P1<P2,由图知压强越大,C的含量越高,所以平衡向正反应进行,增大压强,平衡向体积减小的方向移动,所以m+n>q,故答案为:>.
点评:本题考查外界条件对化学反应速率、化学平衡移动影响、学生识图能力,题目难度不大,做题时注意分析图象曲线的变化特点,根据“先拐先平,数值大”原则,采取定一议二解答.

练习册系列答案
相关题目
下列离子中,不可能与H+大量共存于同一溶液中的是( )
A、S
| ||
| B、Cl- | ||
| C、Cu2+ | ||
D、N
|
硫酸铵[(NH4)2SO4]强热时分解产物为SO2、NH3、N2及H2O.根据氧化还原反应原理,不写方程式即可知道,产物中SO2与N2的体积之比为( )
| A、1:1 | B、2:1 |
| C、3:1 | D、1:3 |
一定温度下,在体积可变的密闭容器中进行的可逆反应:C(s)+CO2(g)═2CO(g),不能判断反应已经达到化学平衡状态的是( )
| A、容器中总压强不变 |
| B、2v正(CO2)=v逆(CO) |
| C、C的质量不再变化 |
| D、容器中CO的体积分数不变 |
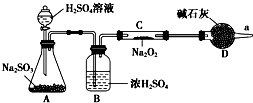 ①某学生根据SO2具有还原性判断SO2和Na2O2反应能生成硫酸钠,该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(A为SO2的发生装置,图中铁架台等装置已略去).
①某学生根据SO2具有还原性判断SO2和Na2O2反应能生成硫酸钠,该同学无法断定反应中是否有氧气生成,拟使用如图所示装置进行实验(A为SO2的发生装置,图中铁架台等装置已略去).