题目内容
硫酸铵[(NH4)2SO4]强热时分解产物为SO2、NH3、N2及H2O.根据氧化还原反应原理,不写方程式即可知道,产物中SO2与N2的体积之比为( )
| A、1:1 | B、2:1 |
| C、3:1 | D、1:3 |
考点:化学方程式的有关计算
专题:计算题
分析:由化合价变化可知,还原产物为SO2,氧化产物为N2,令SO2、N2的物质的量分别为xmol、ymol,根据电子转移守恒列方程,相同条件下体积之比等于物质的量之比.
解答:
解:令SO2、N2的物质的量分别为xmol、ymol,根据电子转移守恒,则:
xmol×(6-4)=ymol×2×[0-(-3)],解得x:y=3:1,
相同条件下体积之比等于物质的量之比,故产物中SO2与N2的体积之比=3:1,
故选:C.
xmol×(6-4)=ymol×2×[0-(-3)],解得x:y=3:1,
相同条件下体积之比等于物质的量之比,故产物中SO2与N2的体积之比=3:1,
故选:C.
点评:本题考查氧化还原反应计算,难度中等,利用电子转移守恒比较简单,树立转移守恒思想在氧化还原反应计算的运用,也可以书写方程式进行计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
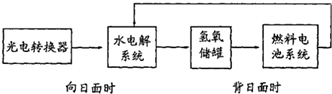 右图是某太空空间站能量转化系统的局部示意图,基中燃料电池采用KOH为电解液,下列有关说法中正确的是( )
右图是某太空空间站能量转化系统的局部示意图,基中燃料电池采用KOH为电解液,下列有关说法中正确的是( )| A、该能量转化系统工作时,需不断补充H2O |
| B、该转化系统的能量本质上来源于太阳能 |
| C、水电解系统中的阴极反应:4OH--4e-=O2+2H2O |
| D、燃料电池放电时的负极反应:H2-2e-=2H+ |
下列说法正确的是( )
| A、元素铯的两种核素137Cs比133Cs多四个质子 |
| B、等质量的H2、D2、T2三种气体的电子数之比为2:3:6 |
| C、一种元素只能有一种质量数 |
| D、在氮原子中,质子数为7而中子数不一定为7 |
下列说法中正确的是( )
| A、化学性质相似的有机物一定是同系物 |
| B、分子组成相差一个或几个CH2原子团的有机物一定是同系物 |
| C、若烃中碳、氢元素的质量分数相同,它们必定是同系物 |
| D、互为同分异构体的两种有机物一定不能互称为同系物 |
在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用( )
| A、NaCl |
| B、HC1 |
| C、NaOH |
| D、CuSO4 |
根据所学知识,下列离子在溶液中易与SCN-结合的是( )
| A、K+ | ||
B、NH
| ||
| C、Na+ | ||
| D、Fe3+ |
在相同的温度和压强下,粒子数相同的任何气体具有相同的( )
| A、质量 | B、密度 |
| C、体积 | D、均不能确定 |
 根据反应:mA(g)+nB(g)?pC(g)△H,结合图中所给的信息填空.
根据反应:mA(g)+nB(g)?pC(g)△H,结合图中所给的信息填空.