题目内容
6.请填写下列空白.(1)实验室里,可用于吸收氯气尾气的一种试剂是NaOH溶液.
(2)某硫酸厂利用SO2尾气、废铁屑、空气、水合成绿矾(FeSO4•7H2O),反应中作还原剂的物质是SO2、废铁屑.
(3)高纯氧化铁可作现代电子工业材料.工业上是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁α-Fe2O3),在制备过程中最后一步如图所示:

写出在空气中煅烧FeCO3,制备高纯氧化铁的化学方程式4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
(4)稀土材料GeO2常作催化剂.煅烧Ge(OH)CO3可制备GeO2,配平该反应的化学方程式:4Ge(OH)CO3+1O2=4GeO2+4CO2+2H2O
(5)高铁酸钾(K2FeO4)可用于净水,是由于FeO42-与水反应产生了强氧化性和吸附能力强的物质,配平该反应的化学方程式:
4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑
分析 (1)氯气可与氢氧化钠溶液反应;
(2)利用SO2尾气、废铁屑、空气、水合成绿矾(FeSO4•7H2O),S、Fe元素化合价升高,被氧化;
(3)FeCO3高温煅烧可得Fe2O3,反应的方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
(4)Ge(OH)CO3→GeO2,失去一个电子,O2→2O2-,得到4个电子,所以得失电子最小公倍数是4,则Ge(OH)CO3的计量数是4,O2的计量数是1;
(5)该反应中Fe元素化合价由+3价变为+6价,O元素化合价由-2价变为0价,根据转移电子守恒、电荷守恒及原子守恒配平方程式.
解答 解:(1)氯气可与氢氧化钠溶液反应而被吸收,故答案为:NaOH溶液;
(2)利用SO2尾气、废铁屑、空气、水合成绿矾(FeSO4•7H2O),S、Fe元素化合价升高,被氧化,则作还原剂的物质是SO2、废铁屑,故答案为:SO2、废铁屑;
(3)FeCO3高温煅烧可得Fe2O3,反应的方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2,故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
(4)Ge(OH)CO3→GeO2,失去一个电子,O2→2O2-,得到4个电子,所以得失电子最小公倍数是4,则Ge(OH)CO3的计量数是4,O2的计量数是1,然后根据原子守恒平衡,所以该反应方程式为4Ge(OH)CO3+1O2═4GeO2+4CO2+2H2O,
故答案为:4;1;4;4;2.
(5)该反应中Fe元素化合价由+3价变为+6价,O元素化合价由-2价变为0价,根据转移电子守恒、电荷守恒及原子守恒配平方程式,可得4FeO42-+10H2O═4Fe(OH)3(胶体)+3O2↑+8OH-,故答案为:4;10;4;8;3.
点评 本题综合考查氧化还原反应,为高频考点,氧化还原反应的计算以及氧化还原反应方程式配平等知识点,会根据原子守恒、转移电子守恒配平方程式,题目难度中等.

| A. | 高纯度的硅可用于制造计算机芯片 | B. | 自然界中存在大量单质硅 | ||
| C. | 地壳中硅的含量稀少 | D. | 光导纤维的主要成分是Si |
| A. | NaOH、Na2O2、NH4Cl | B. | HCl、H2O、Cl2 | ||
| C. | MgCl2、NaF、KOH | D. | Xe、H2SO4、HF |
| A. | NaHCO3和盐酸 | B. | Ca(OH)2和CO2 | C. | Na和O2 | D. | AlCl3与NaOH |
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
| 元素 | A | B | C |
| 结构信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外M层全部充满,N层有一个未成对电子 |
(2)用氢键表示式写出A的氢化物溶液中存在的所有氢键N-H…N或N-H…O或 O-H…N或O-H…O;A的氢化物分子结合一个H+形成阳离子后,其键角变大(填写“变大”、“变小”、“不变”);
(3)C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为[Cu(NH3)4]SO4,
(4)科学家通过X射线推测胆矾中微粒间的作用力,胆矾的结构示意图可简单表示如下:

则胆矾晶体中含有ABCE
A.配位键 B.离子键 C.极性共价键 D.金属键 E.氢键 F.非极性共价键
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键.

在以上分子中,中心原子采用sp3杂化形成化学键是①③④(填写序号).
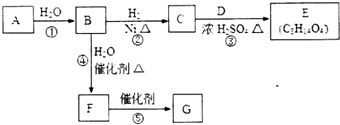 烃的含氧衍生物A是一种重要的有机合成中间体,分子式为C4H2O3,具有五元环结构.由A可以合成有机物E和高分子化合物G,有关物质的转化关系如图所示:
烃的含氧衍生物A是一种重要的有机合成中间体,分子式为C4H2O3,具有五元环结构.由A可以合成有机物E和高分子化合物G,有关物质的转化关系如图所示: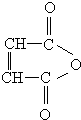 ,B中所含官能团的名称是羧基、碳碳双键;③和⑤的反应类型分别是取代反应、缩聚反应.
,B中所含官能团的名称是羧基、碳碳双键;③和⑤的反应类型分别是取代反应、缩聚反应.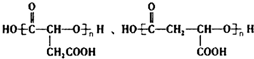 .
. ;
;