题目内容
16.三种常见元素结构信息如表,试根据信息回答有关问题:| 元素 | A | B | C |
| 结构信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外M层全部充满,N层有一个未成对电子 |
(2)用氢键表示式写出A的氢化物溶液中存在的所有氢键N-H…N或N-H…O或 O-H…N或O-H…O;A的氢化物分子结合一个H+形成阳离子后,其键角变大(填写“变大”、“变小”、“不变”);
(3)C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为[Cu(NH3)4]SO4,
(4)科学家通过X射线推测胆矾中微粒间的作用力,胆矾的结构示意图可简单表示如下:

则胆矾晶体中含有ABCE
A.配位键 B.离子键 C.极性共价键 D.金属键 E.氢键 F.非极性共价键
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“○”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键.

在以上分子中,中心原子采用sp3杂化形成化学键是①③④(填写序号).
分析 A原子核外有两个电子层,最外层有3个未成对的电子,外围电子排布为2s22p3,故A为N元素;B原子的M层有1对成对的p电子,外围电子排布为3s23p4,故B为S元素;C原子基态原子核外M层全部充满,N层有一个未成对电子,核外电子数为2+8+18+1=29,则C为Cu.
(1)C为Cu,处于第四周期IB族;
(2)A的氢化物为NH3,在氨水中由于N和O的非金属性较强,O元素、N元素与H原子之间均可形成氢键,氨气分子为三角锥形,N的氢化物分子结合一个H+形成阳离子后,为正四面体结构,键角变大,
(3)硫酸铜溶液中逐滴加入过量氨水,生成的配合物为[Cu(NH3)4]SO4;
(4)在晶体中水分子与铜离子之间是配位键,硫酸根和配离子为离子键,水分子与水分子之间有氢键,水分子中氢氧之间是极性共价键,硫酸根中S与O原子之间形成极性键,
(5)杂化轨道数目=σ键+孤对电子.
解答 解:A原子核外有两个电子层,最外层有3个未成对的电子,外围电子排布为2s22p3,故A为N元素;B原子的M层有1对成对的p电子,外围电子排布为3s23p4,故B为S元素;C原子基态原子核外M层全部充满,N层有一个未成对电子,核外电子数为2+8+18+1=29,则C为Cu.
(1)C为Cu,处于第四周期IB族,元素属于ds区,外围电子排布式:3d104s1,
故答案为:ds;3d104s1;
(2)A的氢化物为NH3,在氨水中由于N和O的非金属性较强,可形成氢键,溶液中存在的氢键有:N-H…N-或N-H…O-或 O-H…N-或O-H…O-等,氨气分子为三角锥形,N的氢化物分子结合一个H+形成阳离子后,为正四面体结构,键角变大,
故答案为:N-H…N或N-H…O或 O-H…N或O-H…O;变大;
(3)硫酸铜溶液中逐滴加入过量氨水,生成的配合物为[Cu(NH3)4]SO4,
故答案为:[Cu(NH3)4]SO4;
(4)胆矾晶体的结构图可知,在晶体中水分子与铜离子之间是配位键,硫酸根和配离子为离子键,水分子与水分子之间有氢键,水分子中氢氧之间是极性共价键,硫酸根中S与O原子之间形成极性键,
故选:ABCE;
(5)①.中心原子成3个单键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化,
②.中心原子成2个单键、1个三键,没有对孤对电子,杂化轨道数为3,采取sp2杂化,
③.中心原子成4个单键,没有对孤对电子,杂化轨道数为4,采取sp3杂化,
④.中心原子成2个单键,含有2对孤对电子,杂化轨道数为4,采取sp3杂化,
故答案为:①③④.
点评 本题考查结构与位置关系、核外电子排布规律、化学键、氢键、杂化理论等,难度不大,旨在考查学生对基础知识的理解掌握.

 如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内液面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中液面继续上升,经过多次重复后,试管内完全被充满,原来试管中盛装的气体是( )
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内液面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中液面继续上升,经过多次重复后,试管内完全被充满,原来试管中盛装的气体是( )| A. | 可能是N2和NO2的混合气体 | B. | 一定是NO2气体 | ||
| C. | 可能是NO和NO2的混合气体 | D. | 只可能是NO2一种气体 |
| 物 质 | 加入试剂的化学式 | 有关离子方程式 |
| NaCl(Na2SO4) | ||
| FeCl2(FeCl3) | ||
| Na2CO3 溶液(NaHCO3) |
| A. | C | B. | F | C. | Cl | D. | N |
| A. | 甲苯、苯、己烯 | B. | 己炔、己烯、四氯化碳 | ||
| C. | 己烷、苯、乙醇 | D. | 己烯、苯、四氯化碳 |
| A. | H2O和D2O | B. | H2和D2 | C. | ${\;}_{1}^{1}H$和${\;}_{1}^{2}H$ | D. | H2O和H2O2 |

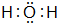 .
.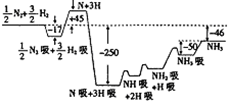 2007年度诺贝尔化学奖获得者格哈德•埃特尔建立了合成氨反应机理,T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ•mol-1.(注:图中“吸”表示在催化剂表面的吸附)请回答下列问题:
2007年度诺贝尔化学奖获得者格哈德•埃特尔建立了合成氨反应机理,T=673K时,各步反应的能量变化如图所示,图中的能量单位为kJ•mol-1.(注:图中“吸”表示在催化剂表面的吸附)请回答下列问题: