题目内容
将等物质的量的金属Na、Mg、Al分别与100mL 2mol/L的盐酸反应,生成气体的体积均为VL(标准状况下),已知:2Na+2H2O=2NaOH+H2,下列说法错误的是( )
| A、反应中,三种金属中有两种金属过量 |
| B、参加反应的金属Na、Mg、Al的物质的量之比为6:3:2 |
| C、镁的物质的量为0.1mol |
| D、V=2.24 |
考点:化学方程式的有关计算
专题:
分析:Na、Mg、Al均与盐酸反应生成氢气,盐酸不足时,Mg、Al不能与水反应,而Na能与水反应生成氢气,根据氢元素守恒,可知Mg、Al与盐酸反应最多生成氢气为0.1L×2mol/L×
=0.1mol,其体积为0.1mol×22.4L/mol=2.24L,由关系式:2Na~H2,Mg~H2,2Al~3H2,可得生成气体与金属的物质的量关系图为: ,据此解答.
,据此解答.
| 1 |
| 2 |
 ,据此解答.
,据此解答.解答:
解:Na、Mg、Al均与盐酸反应生成氢气,盐酸不足时,Mg、Al不能与水反应,而Na能与水反应生成氢气,根据氢元素守恒,可知Mg、Al与盐酸反应最多生成氢气为0.1L×2mol/L×
=0.1mol,其体积为0.1mol×22.4L/mol=2.24L,由关系式:2Na~H2,Mg~H2,2Al~3H2,可得生成气体与金属的物质的量关系图为: ,
,
反应生成气体的体积均为VL(标准状况下),说明反应生成氢气为2.24L,金属Al、Mg过量,Na恰好完全反应,参加反应的金属Na、Mg、Al的物质的量分别为0.2mol、0.1mol、
mol,参加反应的金属Na、Mg、Al的物质的量之比为0.2mol:0.1mol:
mol=6:3:2,综上分析可知,ABD正确,C错误,故选C.
| 1 |
| 2 |
 ,
,反应生成气体的体积均为VL(标准状况下),说明反应生成氢气为2.24L,金属Al、Mg过量,Na恰好完全反应,参加反应的金属Na、Mg、Al的物质的量分别为0.2mol、0.1mol、
| 1 |
| 15 |
| 1 |
| 15 |
点评:本题考查化学方程式的有关计算,属于讨论型计算,题目采取图象法便于判断金属与盐酸反应情况,难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、熵变小于零而焓变大于零的反应肯定不能发生 |
| B、热化学方程式中△H的值与反应物的用量有关 |
| C、化学反应中旧键断裂吸收能量,新键形成释放能量,所以化学反应伴随能量变化,但反应前后物质的总能量不变 |
| D、用蒸馏水稀释0.1mol/L的醋酸至0.01mol/L,稀释过程中温度维持25℃不变,溶液中各离子浓度均减小 |
下列说法正确的是( )
| A、需要加热方能发生的反应一定是吸热反应 |
| B、放热的反应在常温下一定很容易发生 |
| C、反应是放热还是吸热,取决于反应物和生成物所具有的总能量的相对大小 |
| D、伴有能量变化的物质变化都是化学变化 |
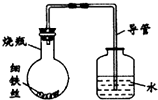 某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
某研究性学习课题组为探究影响钢铁生锈的因素,设计了如下的方案:在A、B、C、D四只小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝,并使铁丝完全浸没在食盐水中,然后装配成如图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm)所示.
 某学生在实验室测定一未知浓度的稀盐酸,已知在25mL氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:
某学生在实验室测定一未知浓度的稀盐酸,已知在25mL氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示: