题目内容
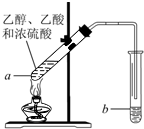 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,再加入2mL乙酸,充分摇匀.在右试管中加入5mL饱和Na2CO3溶液.按图连接好装
置,用酒精灯缓慢加热.
(1)写出左试管中主要反应的方程式
(2)加入浓硫酸的作用:
(3)饱和Na2CO3的作用是:
(4)反应开始时用酒精灯对左试管小火加热的原因是:
(5)分离右试管中所得乙酸乙酯和Na2CO3溶液的操作为(只填名称)
所需主要仪器_
(6)实验生成的乙酸乙酯,其密度比水
考点:乙酸乙酯的制取
专题:实验题
分析:(1)装置中发生的反应是醋酸和乙醇在浓硫酸催化作用下发生酯化反应,生成乙酸乙酯和水;
(2)浓硫酸做酯化反应的催化剂和吸水剂;
(3)实验室里用饱和碳酸钠溶液冷却乙酸乙酯的原因:一是利用碳酸钠溶液中的水溶解乙醇(乙醇在水里的溶解度大于乙酸乙酯),二是碳酸钠能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,而乙酸乙酯难溶于饱和碳酸钠溶液,这样就可以获得较为纯净的乙酸乙酯液体;
(4)根据温度对反应速率影响及乙酸乙酯、乙醇、乙酸的沸点进行分析;
(5)分离互不相溶液体的方法是分液,所用仪器主要为分液漏斗;
(6)乙酸乙酯密度比水小.
(2)浓硫酸做酯化反应的催化剂和吸水剂;
(3)实验室里用饱和碳酸钠溶液冷却乙酸乙酯的原因:一是利用碳酸钠溶液中的水溶解乙醇(乙醇在水里的溶解度大于乙酸乙酯),二是碳酸钠能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,而乙酸乙酯难溶于饱和碳酸钠溶液,这样就可以获得较为纯净的乙酸乙酯液体;
(4)根据温度对反应速率影响及乙酸乙酯、乙醇、乙酸的沸点进行分析;
(5)分离互不相溶液体的方法是分液,所用仪器主要为分液漏斗;
(6)乙酸乙酯密度比水小.
解答:
解:(1)装置中发生的反应是醋酸和乙醇在浓硫酸催化作用下发生酯化反应,生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O;
故答案为:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O;
(2)浓硫酸有吸水性,促进该反应向正反应方向移动,浓硫酸能加快反应速率,所以浓硫酸作催化剂;
故答案为:催化剂、吸水剂;
(3)碳酸钠溶液中的水溶解乙醇,能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,降低乙酸乙酯的溶解度,使乙酸乙酯难溶于饱和碳酸钠溶液,便于分层;
故答案为:除去乙酸,吸收乙醇,降低乙酸乙酯的溶解度,便于分层;
(4)本实验反应开始时用小火加热,目的是加快反应速率,同时由于反应物乙酸、乙醇沸点较低,小火加热防止反应物为来得及反应而挥发损失,
故答案为:加快反应速率,同时防止反应物为来得及反应而挥发损失;
(5)乙酸乙酯的密度比水的小,制得的乙酸乙酯与碳酸钠溶液分层,且处于碳酸钠溶液的上面,因此分离的方法为分液,所用仪器为分液漏斗;
故答案为:分液;分液漏斗;
(6)在饱和碳酸钠上层产生有特殊香味的无色液体为乙酸乙酯,故密度小于水,故答案为:小.
| 浓硫酸 |
| △ |
故答案为:CH3COOH+CH3CH2OH
| 浓硫酸 |
| △ |
(2)浓硫酸有吸水性,促进该反应向正反应方向移动,浓硫酸能加快反应速率,所以浓硫酸作催化剂;
故答案为:催化剂、吸水剂;
(3)碳酸钠溶液中的水溶解乙醇,能跟乙酸反应吸收乙酸,便于闻到乙酸乙酯的香味,降低乙酸乙酯的溶解度,使乙酸乙酯难溶于饱和碳酸钠溶液,便于分层;
故答案为:除去乙酸,吸收乙醇,降低乙酸乙酯的溶解度,便于分层;
(4)本实验反应开始时用小火加热,目的是加快反应速率,同时由于反应物乙酸、乙醇沸点较低,小火加热防止反应物为来得及反应而挥发损失,
故答案为:加快反应速率,同时防止反应物为来得及反应而挥发损失;
(5)乙酸乙酯的密度比水的小,制得的乙酸乙酯与碳酸钠溶液分层,且处于碳酸钠溶液的上面,因此分离的方法为分液,所用仪器为分液漏斗;
故答案为:分液;分液漏斗;
(6)在饱和碳酸钠上层产生有特殊香味的无色液体为乙酸乙酯,故密度小于水,故答案为:小.
点评:本题考查乙酸乙酯的制备,题目难度不大,本题注意把握乙酸乙酯的制备原理和实验方法,学习中注重实验评价能力的培养.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
有A、B、D、E四种金属,当A、B组成原电池时,电子流动方向为A→B;将A、D分别投入等浓度的盐酸中,D比A反应剧烈;用惰性电极电解含有相同浓度的B2+、E2+的溶液时,E2+先被还原.则A、B、D、E金属活泼性由强到弱的顺序为( )
| A、A>B>E>D |
| B、A>B>D>E |
| C、D>E>A>B |
| D、D>A>B>E |
已知反应4A(g)?2B(g)+E(g)△H>0.达到平衡时,要使正反应速率降低,A的浓度增大,可以采取的措施是( )
| A、增大压强 | B、减小压强 |
| C、减少E的浓度 | D、降温 |
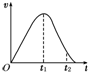 把除去氧化膜的镁条放入盛有一定浓度的稀盐酸的试管中,发现H2的生成速率v随时间t的变化关系如图所示.其中O~t1段速率变化的主要因素是
把除去氧化膜的镁条放入盛有一定浓度的稀盐酸的试管中,发现H2的生成速率v随时间t的变化关系如图所示.其中O~t1段速率变化的主要因素是
 用镁粉、铝粉和炭粉组成的混合物进行如图所示实验,回答下列问题.
用镁粉、铝粉和炭粉组成的混合物进行如图所示实验,回答下列问题. 某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化.
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和炭粉置于锥形瓶底部,塞上瓶塞(如图所示).从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化. (3)该小组对图(a)中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
(3)该小组对图(a)中0~t1时压强变大的原因提出了如下假设,请你完成假设二: