题目内容
已知下列数据:
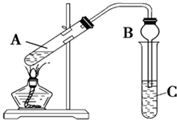
如图a为实验室制取乙酸乙酯的装置图.
(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置.振荡前后的实验现象 (填选项).
A.上层液体变薄 B.下层液体红色变浅或变为无色 C.有气体产生 D.有果香味
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离(图b):
①试剂1最好选用 ;
②操作1是 ,所用的主要仪器名称是 ;
③试剂2最好选用 ;
④操作2是 ;
⑤操作3中温度计水银球的位置应为图(图c)中 (填a、b、c、d)所示,在该操作中,除蒸馏烧瓶、温度计外,还需要的玻璃仪器有 、 、 、 ,收集乙酸的适宜温度是 .

| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 |
| 乙醇 | -144 | 78.0 | 0.789 |
| 乙酸 | 16.6 | 118 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0,900 |
| 浓硫酸(98%) | - | 338 | 1.84 |
(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置.振荡前后的实验现象
A.上层液体变薄 B.下层液体红色变浅或变为无色 C.有气体产生 D.有果香味
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离(图b):
①试剂1最好选用
②操作1是
③试剂2最好选用
④操作2是
⑤操作3中温度计水银球的位置应为图(图c)中

考点:乙酸乙酯的制取
专题:实验题
分析:(1)乙醇、乙酸的沸点较低,易挥发;根据乙酸的酸性和乙酸乙酯难溶于饱和碳酸钠分析;
(2)①饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
②乙酸乙酯不溶于碳酸钠溶液,可以通过分液操作分离;
③根据强酸制弱酸,加硫酸能将乙酸钠转化为乙酸;
④通过操作1得到乙酸乙酯、碳酸钠、乙酸钠、乙醇的混合液,B为乙酸、乙醇、碳酸钠的混合液,通过蒸馏得到乙醇;
⑤根据蒸馏操作使用的仪器判断温度计水银球的位置以及还需要的玻璃仪器;根据反应物、生成物的沸点确定收集乙酸的适宜温度;
(2)①饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
②乙酸乙酯不溶于碳酸钠溶液,可以通过分液操作分离;
③根据强酸制弱酸,加硫酸能将乙酸钠转化为乙酸;
④通过操作1得到乙酸乙酯、碳酸钠、乙酸钠、乙醇的混合液,B为乙酸、乙醇、碳酸钠的混合液,通过蒸馏得到乙醇;
⑤根据蒸馏操作使用的仪器判断温度计水银球的位置以及还需要的玻璃仪器;根据反应物、生成物的沸点确定收集乙酸的适宜温度;
解答:
解:(1)反应物中乙醇、乙酸的沸点较低,制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,碳酸钠水解呈碱性,乙酸乙酯不溶于饱和碳酸钠溶液,密度比水小,有香味,振荡时乙酸和碳酸钠反应而使溶液红色变浅,
故答案为:ABCD;
(2)①制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,所以试剂1最好选用饱和Na2CO3溶液,
故答案为:饱和Na2CO3溶液;
②乙酸乙酯不溶于碳酸钠溶液,所以混合液会分层,可以通过分液操作分离出乙酸乙酯,使用到的主要仪器为分液漏斗,
故答案为:分液;分液漏斗;
③根据流程可知,加入加硫酸能将乙酸钠转化为乙酸,且硫酸难挥发,不影响下步的蒸馏,
故答案为:稀硫酸;
④通过操作1得到乙酸乙酯、碳酸钠、乙酸钠、乙醇的混合液,B为乙酸、乙醇、碳酸钠的混合液,通过蒸馏得到乙醇E,然后加入稀硫酸,再蒸馏得到乙酸,
故答案为:蒸馏;
⑤蒸馏的原理:通过控制沸点的不同来实现物质的分离,所以温度计水银球要靠近蒸馏烧瓶支管口,在蒸馏实验中除蒸馏烧瓶、温度计、冷凝管外,还需要的玻璃仪器有酒精灯、牛角管、锥形瓶,乙酸的沸点为118℃,所以收集乙酸的适宜温度是略高于118℃,
故答案为:b;酒精灯;冷凝管;牛角管;锥形瓶;略高于118℃;
故答案为:ABCD;
(2)①制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,所以试剂1最好选用饱和Na2CO3溶液,
故答案为:饱和Na2CO3溶液;
②乙酸乙酯不溶于碳酸钠溶液,所以混合液会分层,可以通过分液操作分离出乙酸乙酯,使用到的主要仪器为分液漏斗,
故答案为:分液;分液漏斗;
③根据流程可知,加入加硫酸能将乙酸钠转化为乙酸,且硫酸难挥发,不影响下步的蒸馏,
故答案为:稀硫酸;
④通过操作1得到乙酸乙酯、碳酸钠、乙酸钠、乙醇的混合液,B为乙酸、乙醇、碳酸钠的混合液,通过蒸馏得到乙醇E,然后加入稀硫酸,再蒸馏得到乙酸,
故答案为:蒸馏;
⑤蒸馏的原理:通过控制沸点的不同来实现物质的分离,所以温度计水银球要靠近蒸馏烧瓶支管口,在蒸馏实验中除蒸馏烧瓶、温度计、冷凝管外,还需要的玻璃仪器有酒精灯、牛角管、锥形瓶,乙酸的沸点为118℃,所以收集乙酸的适宜温度是略高于118℃,
故答案为:b;酒精灯;冷凝管;牛角管;锥形瓶;略高于118℃;
点评:本题考查了乙酸乙酯的制备方法,注意把握乙酸乙酯的制备原理和实验方法,明确乙酸乙酯与乙酸、乙醇性质的区别方法及浓硫酸的作用.题目难度中等.

练习册系列答案
相关题目
下列实验操作说法正确的是( )
| A、沾附在试管内壁上的油脂,用热碱液洗涤 |
| B、蒸馏操作时应将温度计的水银球插入液面下 |
| C、苯酚有毒,若其浓溶液不慎沾到皮肤上,应立即用NaOH溶液冲洗 |
| D、向蔗糖溶液中加入几滴稀硫酸,水浴加热,再向其中加入银氨溶液,可产生银镜 |
用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是( )
| X | Y | Z | W | |
| A | C | Fe | NaCl | H2O |
| B | Pt | Cu | CuSO4 | CuSO4溶液 |
| C | C | C | H2SO4 | H2O |
| D | Ag | Fe | AgNO3 | AgNO3晶体 |
| A、A | B、B | C、C | D、D |
下列说法正确的是( )
| A、催化剂因反应前后质量和化学性质不改变知催化剂不参加化学反应 |
| B、升温时不论吸热反应还是放热反应,速率都增大 |
| C、一定量的锌与过量的稀硫酸反应制取氢气,一定温度下为减慢反应速率而又不影响生成H2的量,可向其中加入KNO3溶液 |
| D、反应C(固)+H 2O(气)?CO(气)+H2(气)在一可变容积的闭容器中进行,当体积不变,充入N2,体系总压强增大使化学反应速率增加 |
将含有0.4mol Cu(N03)2 和0.4mol KCl 的水溶液 1L,用惰性电极电解一段时间后,在一个电极上析出 0.3mol Cu,此时在另一个电极上放出气体的体积(标准状况下)是( )
| A、13.44 L |
| B、6.72 L |
| C、2.8 L |
| D、5.6 L |
 某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL冰醋酸混合,分别进行制取乙酸乙酯的研究.
某兴趣小组利用如图装置,将不同浓度的硫酸与3mL 无水乙醇和2mL冰醋酸混合,分别进行制取乙酸乙酯的研究.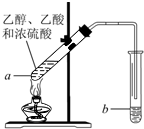 如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,
如图,在左试管中先加入3mL的乙醇,并在摇动下缓缓加入2mL浓硫酸,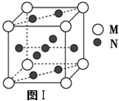 ,则该合金中M和N的原子个数比为
,则该合金中M和N的原子个数比为 ,其中M离子的配位数是
,其中M离子的配位数是