题目内容
20.T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:K=$\frac{c(X)•{c}^{2}(Y)}{{c}^{2}(Z)•{c}^{2}(W)}$,有关该平衡体系的说法正确的是( )| A. | 升高温度,W(g)体积分数增加,则正反应是放热反应 | |
| B. | 减小X浓度,平衡向逆反应方向移动,平衡常数K减小 | |
| C. | 平衡正向移动,化学平衡常数一定增大 | |
| D. | 该反应可表示为X(g)+2Y(g)?2Z(g)+2W(g) |
分析 K为生成物浓度幂之积与反应物浓度幂之积的比,由K=$\frac{c(X)•{c}^{2}(Y)}{{c}^{2}(Z)•{c}^{2}(W)}$,可知反应为2Z(g)+2W(g)?X(g)+2Y(g),
A.升高温度,W(g)体积分数增加,可知升高温度平衡逆向移动;
B.K只与温度有关;
C.平衡正向移动,不能确定温度的变化;
D.由K表达式可知,X、Y为生成物.
解答 解:由K=$\frac{c(X)•{c}^{2}(Y)}{{c}^{2}(Z)•{c}^{2}(W)}$,可知反应为2Z(g)+2W(g)?X(g)+2Y(g),
A.升高温度,W(g)体积分数增加,可知升高温度平衡逆向移动,则正反应是放热反应,故A正确;
B.K只与温度有关,则减小X浓度,平衡向正反应方向移动,平衡常数不变,故B错误;
C.平衡正向移动,不能确定温度的变化,则不能确定K的变化,故C错误;
D.由K表达式可知,X、Y为生成物,Z、W为反应物,故D错误;
故选A.
点评 本题考查化学平衡常数及平衡移动,为高频考点,把握K的意义、K的表达式与反应的关系为解答的关键,侧重分析与应用能力的考查,注意K只与温度有关,题目难度不大.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
10.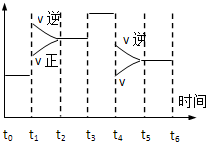 密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )
密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )
 密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )
密闭体系中发生下列反应N2(g)+3H2(g)?2NH3 △H<0,如图是某一时间段中反应速率与反应进程的曲线关系图,下列各时间段内,氮气的百分含量最高的是( )| A. | t0~t1 | B. | t2~t3 | C. | t3~t4 | D. | t5~t6 |
8.下列反应的离子方程式,书写错误的是( )
| A. | 氢氧化钡跟硫酸铜溶液的反应:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ | |
| B. | 石灰石溶于稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 少量的氢氧化钡与硫酸氢钠溶液混合:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 氯化铜溶液与铁粉反应:Cu2++Fe═Fe2++Cu |
10.在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2?Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是( )
| A. | 加MgSO4 | B. | 加HCl溶液 | C. | 加NaOH | D. | 加少量水 |
8.实验室需配置一种仅含四种离子(不考虑水电离出来的离子>的无色混合溶液,且在混合物溶液中四种离子的浓度均为1mol/L,下列四个选项中能达到此目的是( )
| A. | Na+、K+、SO42-、Cl- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | H+、K+、HCO3-、Cl- | D. | Mg2+、Na+、Cl-、SO42- |
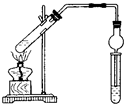 用图所示实验装置制取乙酸乙酯.回答以下问题:
用图所示实验装置制取乙酸乙酯.回答以下问题: 如图所示,在大试管里加入3mL乙醇、2mL冰醋酸,再缓缓加入2mL浓硫酸,边加边振荡.在另一支试管中加入饱和碳酸钠溶液用来吸收反应生成物.
如图所示,在大试管里加入3mL乙醇、2mL冰醋酸,再缓缓加入2mL浓硫酸,边加边振荡.在另一支试管中加入饱和碳酸钠溶液用来吸收反应生成物.