题目内容
15.质量相等的O2与SO2,物质的量之比为2:1,所含原子个数比为4:3.分析 结合n=$\frac{m}{M}$及分子的构成计算.
解答 解:设质量均为m,则质量相等的O2与SO2,物质的量之比为$\frac{m}{32}$:$\frac{m}{64}$=2:1,所含原子个数比为2×2:1×3=4:3,
故答案为:2:1;4:3.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意分子的构成,题目难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
5.已知苯甲酸微溶于水,易溶于乙醇、乙醚,有弱酸性,酸性比醋酸强.它可用于制备苯甲酸乙酯.
制备苯甲酸乙酯的反应原理
 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O
相关物质的部分物理性质如表格:
实验流程如图1:

(1)制备苯甲酸乙酯,图2装置最合适的是B,反应液中的环己烷在本实验中的作用带出生成的水,促进酯化反应向正向进行.

(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.
反应完成的标志是分水器中下层(水层)液面不再升高.
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸,碳酸钠固体需搅拌下分批加入的原因加入过快大量泡沫的产生可使液体溢出.
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用萃取出水层中溶解的苯甲酸乙酯,提高产率.
(5)步骤⑤蒸馏操作中,图3装置最好的是b d(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).

(6)最终得到6.75g纯品,则苯甲酸乙酯的产率是90%.
制备苯甲酸乙酯的反应原理
 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O相关物质的部分物理性质如表格:
| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环已烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环已烷、乙醇和水共沸物 | 62.1 |

(1)制备苯甲酸乙酯,图2装置最合适的是B,反应液中的环己烷在本实验中的作用带出生成的水,促进酯化反应向正向进行.

(2)步骤②控制温度在65~70℃缓慢加热液体回流,分水器中逐渐出现上、下两层液体,直到反应完成,停止加热.放出分水器中的下层液体后,继续加热,蒸出多余的乙醇和环己烷.
反应完成的标志是分水器中下层(水层)液面不再升高.
(3)步骤③碳酸钠的作用是中和苯甲酸和硫酸,碳酸钠固体需搅拌下分批加入的原因加入过快大量泡沫的产生可使液体溢出.
(4)步骤④将中和后的液体转入分液漏斗分出有机层,水层用25mL乙醚萃取,然后合并至有机层,用无水MgSO4干燥.乙醚的作用萃取出水层中溶解的苯甲酸乙酯,提高产率.
(5)步骤⑤蒸馏操作中,图3装置最好的是b d(填标号),蒸馏时先低温蒸出乙醚,蒸馏乙醚时最好采用水浴加热(水浴加热、直接加热、油浴加热).

(6)最终得到6.75g纯品,则苯甲酸乙酯的产率是90%.
3.下列叙述中正确的是( )
| A. | 金属原子失电子越多,其还原性越强 | |
| B. | 制成0.5L 1mol/L的Na2CO3溶液,需要Na2CO3•10H2O晶体质量为143克 | |
| C. | 相同条件下,NA个氧气分子和NA个氮气分子的密度比等于7:8 | |
| D. | 配制480 mL溶液时,选择规格为480 mL的容量瓶 |
10.下列实验设计能完成或实验结论合理的是( )
| A. | NH4Cl固体中混有少量的I2,可用加热的方法将I2除去 | |
| B. | 少量浓硝酸保存在无色细口瓶中 | |
| C. | 用浓硫酸吸收二氧化硫中混有少量SO3气体 | |
| D. | 测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 |
20.T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:K=$\frac{c(X)•{c}^{2}(Y)}{{c}^{2}(Z)•{c}^{2}(W)}$,有关该平衡体系的说法正确的是( )
| A. | 升高温度,W(g)体积分数增加,则正反应是放热反应 | |
| B. | 减小X浓度,平衡向逆反应方向移动,平衡常数K减小 | |
| C. | 平衡正向移动,化学平衡常数一定增大 | |
| D. | 该反应可表示为X(g)+2Y(g)?2Z(g)+2W(g) |
5.将AgCl 和AgI 的饱和溶液相混合,在其中加入足量AgNO3 固体,将会( )
| A. | 只有AgCl 沉淀 | B. | 只有AgI 沉淀 | ||
| C. | AgCl、AgI 都沉淀,以AgCl 为主 | D. | AgCl、AgI 都沉淀,以AgI 为主 |
2.蛇纹石矿可以看做由MgO、Fe2O3、Al2O3和SiO2组成.某实验小组设计如下流程欲分别制得单质Mg、Fe、Al和Si.
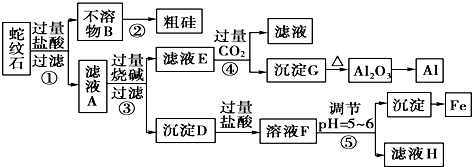
有关氢氧化物沉淀时的pH见如表:
请回答下列问题:
(1)滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+;
(2)操作④中生成沉淀G的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)由G反应生成Al2O3的反应方程式2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(4)操作⑤中调节pH=5~6时,可以用到的试剂为c(填字母).
a.NaOH溶液 b.氨水 c.MgO
(5)由滤液H制取金属Mg的流程如下:
滤液H$\stackrel{加热浓缩}{→}$$\stackrel{冷却结晶}{→}$MgCl2•6MgCl2-→Mg
该流程中由MgCl2冶炼Mg的方法是电解.

有关氢氧化物沉淀时的pH见如表:
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
(1)滤液A中含有的阳离子有Fe3+、Al3+、Mg2+、H+;
(2)操作④中生成沉淀G的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)由G反应生成Al2O3的反应方程式2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(4)操作⑤中调节pH=5~6时,可以用到的试剂为c(填字母).
a.NaOH溶液 b.氨水 c.MgO
(5)由滤液H制取金属Mg的流程如下:
滤液H$\stackrel{加热浓缩}{→}$$\stackrel{冷却结晶}{→}$MgCl2•6MgCl2-→Mg
该流程中由MgCl2冶炼Mg的方法是电解.
3.下列实验事实能用同一原理解释的是( )
| A. | SO2、Cl2都能使品红溶液褪色 | |
| B. | NH4Cl晶体、固体碘受热时都能气化 | |
| C. | 乙烯通入酸性高锰酸钾溶液和溴水都能使其褪色 | |
| D. | 葡萄糖、乙醛分别与新制Cu(OH)2共热时都能产生红色沉淀 |