题目内容
7.铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如图所示,请回答有关问题: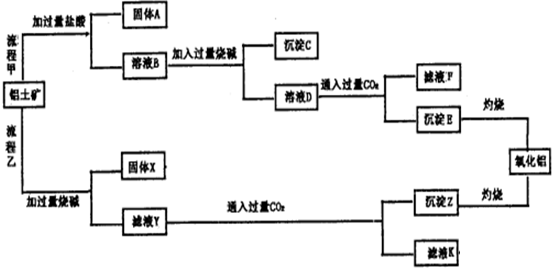
(1)请写出上图中对应物质的化学式:固体A为SiO2,沉淀C为Fe(OH)3,沉淀E为Al(OH)3,固体X为Fe2O3.
(2)溶液B到溶液D发生反应的离子方程式:Al2O3+2OH-+3H2O=2Al(OH)4-、SiO2+2OH-=SiO32-+H2O;沉淀E灼烧分解得到氧化铝的化学方程式为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
(3)验证滤液B含Fe3+,可取少量滤液并加入KSCN(填检验试剂),现象为溶液呈血红色.
(4)滤液K中溶质的主要成份是NaHCO3(填化学式).
分析 向铝土矿中加入过量稀盐酸,二氧化硅不反应,所以固体A为SiO2,滤液中溶质为FeCl3、AlCl3、HCl,向滤液B中加入过量NaOH,沉淀C是Fe(OH)3,滤液D中溶质为NaCl、NaAlO2、NaOH,向溶液中通入过量二氧化碳,沉淀E为Al(OH)3,滤液F中溶质为NaHCO3,灼烧沉淀得到Al2O3;
向铝土矿中加入过量烧碱溶液,发生的反应为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,氧化铁不反应,所以固体X为Fe2O3,滤液Y中成分为NaAlO2、Na2SiO3、NaOH,通入过量二氧化碳时,得到沉淀Z为Al(OH)3、H2SiO3,滤液K中溶质为NaHCO3,灼烧沉淀Z得到氧化铝,以此解答该题.
解答 解:向铝土矿中加入过量稀盐酸,二氧化硅不反应,所以固体A为SiO2,滤液中溶质为FeCl3、AlCl3、HCl,向滤液B中加入过量NaOH,沉淀C是Fe(OH)3,滤液D中溶质为NaCl、NaAlO2、NaOH,向溶液中通入过量二氧化碳,沉淀E为Al(OH)3,滤液F中溶质为NaHCO3,灼烧沉淀得到Al2O3;
向铝土矿中加入过量烧碱溶液,发生的反应为Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O,氧化铁不反应,所以固体X为Fe2O3,滤液Y中成分为NaAlO2、Na2SiO3、NaOH,通入过量二氧化碳时,得到沉淀Z为Al(OH)3、H2SiO3,滤液K中溶质为NaHCO3,灼烧沉淀Z得到氧化铝,
(1)由以上分析可知A为SiO2,C为Fe(OH)3,E为Al(OH)3,X为Fe2O3,故答案为:SiO2;Fe(OH)3;Al(OH)3;Fe2O3;
(2)流程乙加入烧碱后发生反应的离子方程式:Al2O3+2OH-+3H2O=2Al(OH)4-、SiO2+2OH-=SiO32-+H2O,灼烧沉淀E发生的化学反应方程式为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:Al2O3+2OH-+3H2O=2Al(OH)4-、SiO2+2OH-=SiO32-+H2O;2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
(3)铁离子和KSCN溶液混合发生反应生成络合物而导致溶液呈血红色,所以可以用KSCN溶液检验铁离子,则验证滤液B含Fe3+,可取少量滤液并加入KSCN溶液,
故答案为:KSCN;溶液呈血红色;
(4)通过以上分析知,滤液K中溶质的主要成份是NaHCO3,故答案为:NaHCO3.
点评 本题考查物质分离和提纯方法的选择和运用,为高频考点,明确各个流程发生的反应及沉淀和滤液成分是解本题关键,熟悉常见元素化合物结构和性质,知道铁离子检验方法及现象,题目难度不大.

| A. | 60mL | B. | 45mL | C. | 30mL | D. | 15mL |
| A | H2SO3→H2SO4: | 2H2SO3+O2=2H2SO4 |
| B | Fe→Fe3+: | 2Fe+6H+=2Fe3++3H2↑ |
| C | Br-→Br2: | 2Br-+I2=B r2+2I- |
| D | Cu→CuSO4: | Cu+2H2SO4(稀)=CuSO4+SO2↑+2H2O |
| A. | A | B. | B | C. | C | D. | D |
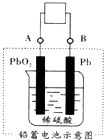 电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:
电瓶车所用的电池一般是铅蓄电池,图是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,
根据上述变化,下列说法中正确的是( )
| A. | 放电时电极 PbO2 发生氧化反应 | |
| B. | 放电时电子流向由B到A | |
| C. | 工作时蓄电池里电解质溶液的pH不变 | |
| D. | 充电时阴极反应是PbSO4-2e-+2H2O═PbO2+4H++SO42- |
| A. | 醋酸 | B. | 酒精 | C. | 铜 | D. | 硫酸钡 |
| A. | 水泥 | B. | 水玻璃 | C. | 氨水 | D. | 液氯 |
| A. | 铁粉跟稀硫酸反应 2Fe+6H+=2Fe3++3H2↑ | |
| B. | 铝跟氢氧化钠溶液反应 2Al+2H2O+2OH-=2 AlO2-+3H2↑ | |
| C. | 氯气和水的反应 C12+H2O=2H++C1-+ClO- | |
| D. | 少量铜屑放入稀硝酸中 Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
 PbO2+Pb+2H2SO4,则该铅蓄电池在充电时阳极的电极反应式:PbSO4-2e-+2H2O═PbO2+SO42-+4H+.
PbO2+Pb+2H2SO4,则该铅蓄电池在充电时阳极的电极反应式:PbSO4-2e-+2H2O═PbO2+SO42-+4H+.