题目内容
5.氯气是一种重要的工业原料,在纺织、造纸、化工合成方面都有重要的用途.(1)工业上电解饱和食盐水制取氯气:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,理论上每转移1mol电子,生成的氯气在标准状况下的体积为11.2L,工业上将生成的氯气通入石灰乳制取漂白粉,请写出该反应的化学方程式2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O.
(2)实验室用MnO2与浓盐酸共热制氯气,试写出该反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O,若用100mL 12mol•L-1的浓盐酸与足量的MnO2反应,则生成的氯气在标准状况下的体积<6.72L(填“>”、“<”或“=”).
分析 (1)电解氯化钠溶液生成氯气和氢气,反应中Cl元素化合价由-1价升高到0价,氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
(2)加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气,二氧化锰和稀盐酸不反应.
解答 解:(1)电解氯化钠溶液生成氯气和氢气,反应中Cl元素化合价由-1价升高到0价,则理论上每转移1mol电子,生成的氯气为0.5mol,在标准状况下的体积为11.2L,氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,
故答案为:11.2;2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;
(2)加热条件下,浓盐酸和二氧化锰发生氧化还原反应生成氯气,方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O,二氧化锰和稀盐酸不反应,则用100mL 12mol•L-1的浓盐酸与足量的MnO2反应,则生成的氯气在标准状况下的体积小于理论值.
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2+2H2O;<.
点评 本题考查氧化还原反应以及氯气的性质,为高频考点,侧重考查学生的分析能力,题目难度不大,注意从化合价变化的角度分析氧化还原反应并进行相关的计算.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
15.NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的氢离子数为2NA | |
| C. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
16. 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | 该反应进行到M点放出的热量大于进行到W点放出的热量 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | M点的正反应速率v正大于N点的逆反应速率v逆 | |
| D. | M点的正反应速率小于W点的逆反应速率 |
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L水中含有水分子数为NA | |
| B. | 1mol Na2CO3 固体中含有的钠离子数为NA | |
| C. | 16g O2中含有的氧原子数为NA | |
| D. | 0.1mol/L的NaOH溶液中含有OH-的数为NA |
20.下列有关胶体及分散系的说法正确的是( )
| A. | 胶体粒子直径大于100nm | |
| B. | 丁达尔效应可以用于检验胶体 | |
| C. | 将FeCl3溶液滴加到氢氧化钠溶液中即可制得氢氧化铁胶体 | |
| D. | 分离胶体和溶液可以采用过滤的方法 |
10.下列各组物质相互混合反应后,最终有白色沉淀生成的是( )
①金属钠投入到FeCl2溶液中
②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④向饱和Na2CO3溶液中通入过量CO2.
①金属钠投入到FeCl2溶液中
②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④向饱和Na2CO3溶液中通入过量CO2.
| A. | ①②③④ | B. | ①④ | C. | ③④ | D. | ②③ |
15.如图图象中,纵坐标为沉淀物的物质的悬,横坐标为向溶液中加入反应物的物质的量,则相应的图象序号与(1)-(4)对应的是BCAD


| 溶液 | 加入物质 | 对应的图象 |
| (1)饱和石灰水 | 通过量CO2气体 | |
| (2)氯化铝溶液 | 加入过量氨水 | |
| (3)MgCl2、AICl3的混合液 | 逐滴加入NaOH溶液至过量 | |
| (4)含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 |
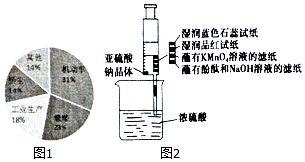 晋中市气象台2017年1月7日11时35分发布了雾霾黄色预警,随后晋中市发布了机动车限行通告.通过调查发现,形成雾霾的污染来源如图1所示.主要是机动车排放物和燃煤废气,其中会有大量的NOx和SO2.
晋中市气象台2017年1月7日11时35分发布了雾霾黄色预警,随后晋中市发布了机动车限行通告.通过调查发现,形成雾霾的污染来源如图1所示.主要是机动车排放物和燃煤废气,其中会有大量的NOx和SO2.