题目内容
19.下列化合物,既有离子键也有共价键的是( )| A. | 氯化氢 | B. | 硫酸 | C. | 氯化铵 | D. | 乙酸 |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,以此来解答.
解答 解:A.HCl中只含共价键,故A不选;
B.硫酸只含共价键,故B不选;
C.氯化铵中含离子键和N-H共价键,故C选;
D.乙酸只含共价键,故D不选;
故选C.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键及铵盐为离子化合物,题目难度不大.

练习册系列答案
相关题目
9.室温下,水的电离达到平衡:H2O?H++OH-.下列叙述正确的是( )
| A. | 将水加热,平衡向正反应方向移动,Kw不变 | |
| B. | 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 | |
| D. | 向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)═c(H+) |
10.下列关于胶体的叙述正确的是( )
| A. | NaCl分散在无水酒精中,形成的分散系是胶体 | |
| B. | 胶体区别于其他分散系的本质特征是丁达尔效应 | |
| C. | 胶体带电荷,而溶液呈电中性 | |
| D. | 在胶体中通电时,分散质微粒一定向某一极移动,在溶液中通电时,溶质微粒一定向两极移动 |
7.下列说法正确的是( )
| A. | 加大煤燃烧时与空气的接触面积,是为了获得更多的能量 | |
| B. | 钢铁易生锈被腐蚀,而铝、银等金属不容易被腐蚀,是因为铁的活泼性强 | |
| C. | 氢氧燃料电池把氢气和氧气燃烧放出的热能转化为电能 | |
| D. | 在实验室使用大理石与稀盐酸反应制取CO2,是为了控制CO2生成的速率 |
14.某主族元素原子R的第五电子层上只有一个电子.下列描述正确的是( )
| A. | 其单质在常温下跟水的反应不如钠剧烈 | |
| B. | 其原子半径比钾离子半径小 | |
| C. | In是第5周期ⅠB族元素 | |
| D. | 其氢氧化物能使氢氧化铝溶解 |
4.实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O.关于该反应的下列说法错误的是( )
| A. | NaNO2是氧化剂 | |
| B. | 氧化剂与还原剂物质的量之比为1:1 | |
| C. | NH4Cl中的氮元素被氧化 | |
| D. | 每生成1 mol N2转移的电子的物质的量为6 mol |
11.如表是元素周期表的一部分,针对表中的①〜⑩种元素,问答下列问题
(1)元素①的名称是硼,比元素⑧质子数多10的元素在周期表中所处位置第四周期第ⅤⅢ族
(2)元素③的气态氢化物与其最高价氧化物的水化物反应的方程式为NH3+HNO3=NH4NO3
(3)用电子式表示元素⑨与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(4)表示②与⑦形成的化合物的电子式: ,该化合物是由极性(填“极性”或“非极性”)键形成的.
,该化合物是由极性(填“极性”或“非极性”)键形成的.
(5)元素⑥的氢化物的结构式为H-S-H;该氢化物常温下和元素⑦的单质反应的化学方程式为H2S+Cl2=S+2HCl
(6)④,⑥、⑦三种元素形成的简单离子,离子半径由大到小的顺序是S2->Cl->O2-•
(7)某原子有6个电子、7个中子,写出其元素符号:$\stackrel{13}{6}$C.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | VIA | ⅥA | O族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(2)元素③的气态氢化物与其最高价氧化物的水化物反应的方程式为NH3+HNO3=NH4NO3
(3)用电子式表示元素⑨与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)表示②与⑦形成的化合物的电子式:
 ,该化合物是由极性(填“极性”或“非极性”)键形成的.
,该化合物是由极性(填“极性”或“非极性”)键形成的.(5)元素⑥的氢化物的结构式为H-S-H;该氢化物常温下和元素⑦的单质反应的化学方程式为H2S+Cl2=S+2HCl
(6)④,⑥、⑦三种元素形成的简单离子,离子半径由大到小的顺序是S2->Cl->O2-•
(7)某原子有6个电子、7个中子,写出其元素符号:$\stackrel{13}{6}$C.
8.图示意铝在氧气中燃烧的实验,铝条点燃后,为维持燃烧继续,正确的操作是( )
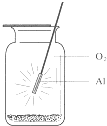

| A. | 铝条应始终置于集气瓶瓶口位置 | |
| B. | 迅速将铝条插入集气瓶接近瓶底位置 | |
| C. | 将铝条从瓶口位置慢慢伸向瓶底位置 | |
| D. | 铝条应不断上下移动 |
9.下列溶液中物质的量浓度为1mol•L-1的是( )
| A. | 将40g NaOH溶解在1L 水中 | |
| B. | 将22.4LHCl气体溶于水配成1L溶液 | |
| C. | 将1 L10mol•L-1的浓盐酸加入9L水中 | |
| D. | 将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |