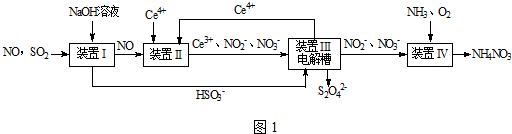
题目内容
9.室温下,水的电离达到平衡:H2O?H++OH-.下列叙述正确的是( )| A. | 将水加热,平衡向正反应方向移动,Kw不变 | |
| B. | 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 | |
| C. | 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 | |
| D. | 向水中加入少量CH3COONa固体,平衡向正反应方向移动,c(OH-)═c(H+) |
分析 依据影响水电离的因素分析判断,水的电离过程是吸热过程,升温促进电离,加入酸或碱抑制水的电离,加入能水解的盐或和水反应的物质促进水的电离,温度一定溶液中离子积常数不变等来解答.
解答 解:A、水的电离吸热,将水加热,平衡向正反应方向移动,KW增大,故A错误;
B、向水中加入少量NaOH固体,c(OH-)增大,平衡向逆向移动,故B错误;
C、向水中加入少量盐酸,c(H+)增大,平衡向逆向移动,故C正确;
D、由水的电离方程式可知水电离出c(OH-)和 c(H+)相等,向水中加少量CH3COONa固体,醋酸根离子与水电离的氢离子结合生成醋酸,降低了氢离子浓度,平衡正向移动,c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了水的电离平衡的影响因素和水的离子积常数,综合性较强,题目难度中等,特别注意在任何情况下由水电离出c(OH-)和 c(H+)相等.

练习册系列答案
相关题目
20.某气态烃A,1mol能与2mol HCl完全加成生成B,B上的氢原子被Cl原子完全取代需要8mol Cl2,则A可能是( )
| A. | 丙炔 | B. | 2-丁炔 | C. | 1-丁烯 | D. | 2-甲基丙烯 |
17.下列各组中的性质比较,不正确的是( )
| A. | 碱性:KOH>NaOH>Mg(OH)2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 稳定性:NH3<PH3<SiH4 | D. | 还原性:F-<Cl-<Br- |
4.一种熔融碳酸盐燃料电池的工作原理如图所示.下列有关该电池说法正确的是( )
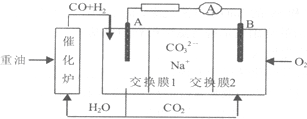

| A. | 重油是石油分馏的产品,含有的主要元素为C、H、O | |
| B. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- | |
| C. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O | |
| D. | 电池工作时,CO32-向电极B移动 |
14.下列物质中,属于同分异构体的是( )
| A. | C3H8与C4H10 | B. | 正丁烷与异丁烷 | C. | H(氢)与D(重氢) | D. | 金刚石与石墨 |
1.下列叙述中正确的是( )
| A. | 电力是一次能源 | B. | 水力是二次能源 | ||
| C. | 煤、石油、天然气是一次能源 | D. | 水煤气是一次能源 |
18.组成和结构可用 表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )
 表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )| A. | 9种 | B. | 12种 | C. | 24种 | D. | 36种 |
19.下列化合物,既有离子键也有共价键的是( )
| A. | 氯化氢 | B. | 硫酸 | C. | 氯化铵 | D. | 乙酸 |