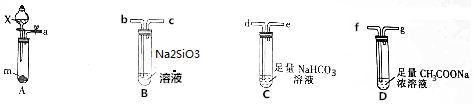
题目内容
5.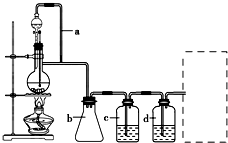 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH═CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{Ni,△}^{H_{2}}$CH3CH2CH2CH2OH
CO的制备原理:HCOOH$→_{△}^{浓H_{2}SO_{4}}$CO↑+H2O,并设计出原料气的制备装置(如图).
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯.写出化学反应方程式:Zn+2HCl=ZnCl2+H2↑,(CH3)2CHOH$→_{△}^{催化剂}$CH2=CHCH3↑+H2O;
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是恒压,防倒吸;c和d中盛装的试剂分别是NaOH溶液,浓H2SO4.若用以上装置制备H2,气体发生装置中必需的玻璃仪器名称是分液漏斗、蒸馏烧瓶;请在虚线框内画出收集干燥H2的装置图.
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是④⑤①②③(或④⑤①③②)(填序号).
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是b.
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:
粗品$→_{操作1}^{试剂1}$滤液$→_{操作2}^{乙醚}$ $\stackrel{分液}{→}$有机层$→_{过滤}^{干燥剂}$ 1-丁醇,乙醚$\stackrel{操作3}{→}$纯品
试剂1为饱和NaHSO3溶液,操作1为过滤,操作2为萃取,操作3为蒸馏.
分析 (1)制备氢气选用锌粒和稀盐酸;制备丙烯选用2-丙醇和浓硫酸;
(2)在题给装置中,a的作用保持分液漏斗和烧瓶内的气压相等,以保证分液漏斗内的液体能顺利加入烧瓶中;b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,d为除去CO中的H2O,试剂选用浓硫酸;若用题给装置制备H2,则不需要酒精灯;
(3)检验丙烯和少量SO2、CO2及水蒸气组成的混合气体各成分时,应首先选④无水CuSO4检验水蒸气,然后用⑤品红溶液检验SO2,并用①饱和Na2SO3溶液除去SO2;然后用③石灰水检验CO2,用②酸性KMnO4溶液检验丙烯;
(4)题给合成正丁醛的反应为气体体积减小的放热反应,为增大反应速率和提高原料气的转化率;
(5)饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开;
解答 解:(1)氢气可用活泼金属锌与非氧化性酸盐酸通过置换反应制备,氧化性酸如硝酸和浓硫酸与锌反应不能产生氢气,方程式为Zn+2HCl=ZnCl2+H2↑;2-丙醇通过消去反应即到达丙烯,方程式为 (CH3)2CHOH$→_{△}^{催化剂}$CH2=CHCH3↑+H2O,
故答案为:Zn+2HCl=ZnCl2+H2↑; (CH3)2CHOH$→_{△}^{催化剂}$CH2=CHCH3↑+H2O;
(2)甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸.又因为甲酸易溶于水,所以必需防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO.为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压;若用以上装置制备氢气,就不再需要加热,所以此时发生装置中的玻璃仪器名称是分液漏斗和蒸馏烧瓶;氢气密度小于空气的,因此要收集干燥的氢气,就只能用向下排空气法,而不能用排水法收集;
故答案为:恒压,防倒吸; NaOH溶液,浓H2SO4;分液漏斗、蒸馏烧瓶; ;
;
(3)检验丙烯可以用酸性KMnO4溶液,检验SO2可以用酸性KMnO4溶液褪色、品红溶液或石灰水,检验CO2可以石灰水,检验水蒸气可以无水CuSO4,所以在检验这四种气体必需考虑试剂的选择和顺序.只要通过溶液,就会产生水蒸气,因此先检验水蒸气;然后检验SO2并在检验之后除去SO2,除SO2可以用饱和Na2SO3溶液,最后检验CO2和丙烯,因此顺序为④⑤①②③(或④⑤①③②),
故答案为:④⑤①②③(或④⑤①③②);
(4)由于反应是一个体积减小的可逆反应,所以采用高压,有利于增大反应速率和提高原料气的转化率;正向反应是放热反应,虽然低温有利于提高原料气的转化率,但不利于增大反应速率,因此要采用适当的温度;催化剂不能提高原料气的转化率,但有利于增大反应速率,缩短到达平衡所需要的时间,故正确所选项是b;
故答案为:b.
(5)粗品中含有正丁醛,根据所给的信息利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇.因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开.
故答案为:饱和NaHSO3溶液;过滤;萃取;蒸馏.
点评 本题考查有机物合成方案的设计,题目难度中等,综合性较强,答题时注意把握物质的分离、提纯方法、制备实验过程,把握物质的性质的异同是解答该题的关键.

| A. | 10% | B. | 25% | C. | 50% | D. | 67% |
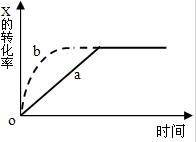 图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )
图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 升高温度 | B. | 加大X的投入量 | C. | 使用催化剂 | D. | 缩小体积 |
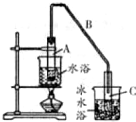 某化学小组以环己醇
某化学小组以环己醇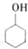 制备环己烯:已知
制备环己烯:已知| 密度(g/cm3) | 溶点(℃) | 沸点(℃) | 溶解性 | |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |
①写出环已醇制备环已烯的化学反应方程式

②A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
③试管C置于冰水浴中的目的是冷却,防止环己烯挥发.
(2)环已烯粗品中含有环已醇和少量酸性杂成等.需要提纯.
①加入饱和食盐水,振荡、静置、分层,水在下层(填上或下).分液后用c (填入编号)洗涤.
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环已烯热馏,蒸馏时要加入生石灰,目的是除去环已烯中混有的少量水.
③收集产品时,控制的温度应在83℃左右.
(3)以下区分环已烯精品和粗品的方法,合理的是b.
a.用酸性高锰酸钾溶液b.用金属钠 c.溴水.
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ/mol
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 反应①要吸收热量,故反应②更实用些 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ/mol |
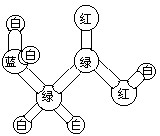 如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )
如图是某分子的球棍模型图.图中“棍”代表单键、双键或三键.不同颜色的球代表不问元素的原子,该模型图可代表一种( )| A. | 卤代羧酸 | B. | 酯 | C. | 氨基酸 | D. | 醇 |
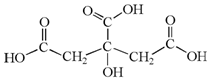 柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )
柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )| A. | 柠檬酸的分子式是C6H8O7 | B. | 柠檬酸是易溶于水的有机物 | ||
| C. | 柠檬酸分子中含有羧基和羟基 | D. | 柠檬酸只能发生取代反应 |