题目内容
18.已知物质酸性强弱顺序.H2SO3>CH3COOH>H2CO3>H2SiO3,非金属性强弱顺序:S>C>Si,为验证上述物质酸性及元素非金属性的强弱,某化学兴趣小组设计如下实验.(加热及夹持装置省略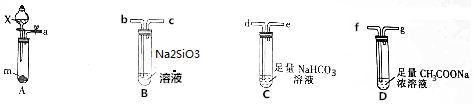
(1)仪器X的名称是分液漏斗,其盛装的液体试剂是浓硫酸.
(2)装置D需微热,按气流从左到右的顺序连接好仪器a→f,g→d,e→b.
(3)试剂m是一种正盐,焰色反应为黄色,则M的化学式是Na2SO3.
(4)装置B中发生反应的离子方程式为CO2+H2O+SiO32-=CO32-+H2SiO3↓.
(5)装置D中足量的CH3COONa浓溶液的作用除可以产生CH3COOH蒸气外,还能验证酸性H2SO3>CH3COOH.
分析 较强酸能和弱酸盐反应生成弱酸,元素的非金属性越强,其最高价氧化物的水化物酸性越强,要验证物质酸性强弱顺序为H2SO3>CH3COOH>H2CO3>H2SiO3,应该用A制取二氧化硫、用D装置生成乙酸、用C装置生成二氧化碳、用D装置生成硅酸即可,再结合题目分析解答.
解答 解:较强酸能和弱酸盐反应生成弱酸,元素的非金属性越强,其最高价氧化物的水化物酸性越强,要验证物质酸性强弱顺序为H2SO3>CH3COOH>H2CO3>H2SiO3,应该用A制取二氧化硫、用D装置生成乙酸、用C装置生成二氧化碳、用D装置生成硅酸即可,
(1)仪器X的名称是分液漏斗,用浓硫酸制取二氧化硫,其盛装的液体试剂是浓硫酸,故答案为:浓硫酸;
(2)该整套装置中应该用A制取二氧化硫、用D装置生成乙酸、用C装置生成二氧化碳、用D装置生成硅酸,所以装置D需微热,按气流从左到右的顺序连接好仪器a→f,g→d,e→b,
故答案为:f;g;d;b;
(3)试剂m是一种正盐,焰色反应为黄色,说明含有Na元素,浓硫酸和亚硫酸钠反应生成二氧化硫,反应方程式为H2SO4(浓)+Na2SO3=Na2SO4+H2O+SO2↑,则M的化学式是Na2SO3,
故答案为:Na2SO3;
(4)装置B中为二氧化碳和硅酸钠溶液的反应,发生反应的离子方程式为CO2+H2O+SiO32-=CO32-+H2SiO3↓,
故答案为:CO2+H2O+SiO32-=CO32-+H2SiO3↓,
(5)装置D中足量的CH3COONa浓溶液的作用除可以产生CH3COOH蒸气外,还能验证酸性H2SO3>CH3COOH,故答案为:验证酸性H2SO3>CH3COOH.
点评 本题考查性质实验方案设计题,为高频考点,侧重考查学生实验设计及实验操作能力,明确实验原理及实验目的是解本题关键,熟练掌握元素化合物性质及转化,注意A制取二氧化硫时不能用稀盐酸,因为盐酸挥发出的HCl能和乙酸钠反应生成乙酸而干扰实验,为易错点.

| A. | CH4和C2H4 | B. | C2H2和C2H4 | C. | C2H4和C2H6 | D. | C4H8和C3H6 |
| A. | 25℃时,1LpH=2的HCl溶液中,由水电离出的H+的数目0.01NA | |
| B. | 标准状况下,2.24L的CCl4中含有的氯原子数为0.4NA | |
| C. | 常温下,1molCO2中含有的共用电子对数目为2NA | |
| D. | 标准状况下,2.24L Cl2与水充分反应,转移的电子数小于0.1NA |
| A. | HCl | B. | NH4Cl | C. | NaHSO4 | D. | H2SO4 |
| A. | FeC13和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 | |
| B. | 其他条件不变,向稀H2SO4与过量Zn的混合物中加少量铜片,既能增大H2生成速率,又能减小生成H2的物质的量 | |
| C. | 其他条件不变,加热或加压都能使H2(g)+I2(g)?2HI(g)的v正和v逆同时增大 | |
| D. | v=$\frac{△c}{△t}$是化学上表示化学反应速率的唯一方法 |
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| A | B | C | ||
| ① | 2 | 1 | 0 | 0.75Q kJ |
| ② | 0.4 | 0.2 | 1.6 | |
| A. | 容器①、②中反应的平衡常数均为18 | |
| B. | 容器②中达到平衡时放出的热量为0.05Q kJ | |
| C. | 向容器①中通入氦气,平衡时A的转化率增大 | |
| D. | 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3 |

部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑,现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸0.49t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷,炉渣的主要成分是CaSiO3(填化学式),冷凝塔1的主要沉积物是液态白磷,冷凝塔2的主要沉积物是固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去SiF4、H2S、HF;再通入次氯酸钠溶液,可除去PH3(均填化学式).
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是产品纯度高.

 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: