题目内容
14.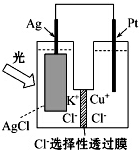 一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )| A. | 生成108g银,转移电子个数为1mol | |
| B. | Cu+在负极发生氧化反应 | |
| C. | Ag电极活泼,Ag失电子发生氧化反应 | |
| D. | Cl-由负极迁移到正极 |
分析 该装置中AgCl中的银离子,在银电极上得电子发生还原反应,所以银作正极,铂作负极,负极上Cu+失电子生成Cu2+,电流从负极沿导线流向正极,电解质溶液中阴离子向负极移动,结合方式中银与电子的关系计算分析.
解答 解:A.正极上的反应为AgCl(s)+e-═Ag(s)+Cl-(aq),生成108g即1mol银,转移电子的物质的量为1mol,电子个数为NA,故A错误;
B.铂作负极,负极上Cu+失电子生成Cu2+,则Cu+在负极发生氧化反应,故B正确;
C.AgCl中的银离子,在银电极上得电子发生还原反应,所以银作正极,Ag电极不发生反应,故C错误;
D.原电池中阴离子向负极移动,即Cl-由正极迁移到负极,故D错误;
故选B.
点评 本题考查了原电池原理,根据图中得失电子确定正负极,再结合电流方向、电极反应来分析解答,题目难度不大,侧重于考查学生的分析能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列过程吸收热量的是( )
| A. | 碘的升华 | B. | 天然气燃烧 | C. | 铝热反应 | D. | 钠与水反应 |
5.下列各组离子能大量共存的是( )
| A. | 向溶液中通入氯气:Ca2+、CH3COO-、Br-、Na+ | |
| B. | 碱性溶液:Na+、SO42-、Cl-、ClO- | |
| C. | 加入浓盐酸的溶液:Fe2+、K+、NO3-、NH4+ | |
| D. | 由水电离出的c(H+)=1×10-12的溶液:K+、Ca2+、Br-、HCO3- |
2.对下列现象或事实的解释不正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 铝箔在酒精灯上加热,溶化后的液态铝不滴落 | 高熔点的氧化铝薄膜兜在铝的外面,阻止了液态铝滴落 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 铁放在冷浓硝酸中不溶解,无红棕色气体产生 | 铁遇浓硝酸钝化,表面形成致密的氧化膜,阻止内部铁继续与硝酸反应 |
| D | Na着火不能用水灭火 | Na遇水剧烈反应,易引发爆炸 |
| A. | A | B. | B | C. | C | D. | D |
19.等物质的量浓度、等体积的下列溶液中:①H2CO3 ②Na2CO3 ③NaHCO3 ④NH4HCO3 ⑤(NH4)2CO3.下列关系或者说法错误的是( )
| A. | c(CO32-)的大小关系为:②>⑤>③>④>① | |
| B. | 将溶液蒸干灼烧只有②能得到对应的固体物质 | |
| C. | ③④⑤既能与盐酸反应,又能与NaOH溶液反应 | |
| D. | c(HCO3-)的大小关系为:④>③>⑤>②>① |
14.下列各组元素中,第一电离能大小次序不正确的是( )
| A. | Mg>Al | B. | S<P | C. | K<Cs | D. | Br<Cl |