题目内容
9.雾霾和光化学烟雾等大气污染严重影响了人们的生活和健康,治理污染气体(NO2、NO、SO2等)保护环境,有利于实现可持续发展.(1)NO2可用水吸收,相应的化学反应方程式为3NO2+H2O=2HNO3+NO;在一定条件下,用氨气可以把NO2、NO还原成无色无毒气体直接排放,则NO转化为无毒气体的方程式为6NO+4NH3=5N2+6H2O.
(2)实验室里,处理含氮氧化物的尾气一般用NaOH溶液来吸收,其反应式为:2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O,现有标准状况下aLNO2和bLNO的混合气恰好被100mLNaOH溶液完全吸收,则a、b应满足的关系为a≥b,NaOH溶液的物质的量浓度为$\frac{a+b}{2.24}$mol•L-1(用含a、b的代数式表示).
(3)硫酸工业生产中,处理SO2尾气先用氨水吸收,然后再与硫酸反应,释放出SO2循环利用,生成的硫酸铵做氮肥.氨水吸收SO2时有关反应的离子方程式为2NH3•H2O+SO2=2NH4++SO32-+H2O、H2O+SO32-+SO2=2HSO3-.
(4)烟气中的SO2经过下列转化可以得到化工产品A.
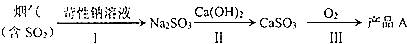
产品A的化学式为CaSO4,上述转化过程中可循环使用的物质是氢氧化钠溶液.
分析 (1)二氧化氮和水发生氧化还原反应生成硝酸和NO;氨气可以把NO2、NO还原成无色无毒气体氮气;
(2)2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O,根据气体完全被吸收时,NO不能剩余即可;根据氮元素守恒以及钠元素守恒计算氢氧化钠的浓度;
(3)二氧化硫与氨水反应生成亚硫酸铵,二氧化硫过量得到的是亚硫酸氢铵溶液;
(4)亚硫酸钙很容易被氧气氧化得到硫酸钙,据流程确定循环使用的物质.
解答 解:(1)二氧化氮和水发生氧化还原反应生成硝酸和NO,反应方程式为3NO2+H2O=NO+2HNO3;氨气可以把NO2、NO还原成无色无毒气体氮气,反应方程式为:6NO+4NH3=5N2+6H2O,故答案为:3NO2+H2O=2HNO3+NO;6NO+4NH3=5N2+6H2O;
(2)2NO2+2NaOH═NaNO2+NaNO3+H2O,NO+NO2+2NaOH═2NaNO2+H2O,根据第二个反应,a=b即可,根据第一个反应需要a大于b,所以a≥b,钠元素全部进入盐溶液,所以钠元素的物质的量就是氮元素的物质的量,NaOH溶液的物质的量浓度为=$\frac{\frac{a+b}{22.4}mol}{0.1L}$=$\frac{a+b}{2.24}$,故答案为:a≥b; $\frac{a+b}{2.24}$;
(3)二氧化硫与氨水反应生成亚硫酸铵,离子方程式为:2NH3•H2O+SO2=2NH4++SO32-+H2O;二氧化硫过量得到的是亚硫酸氢铵溶液,即NH3•H2O+SO2=NH4++HSO3-,故答案为:2NH3•H2O+SO2=2NH4++SO32-+H2O;H2O+SO32-+SO2=2HSO3-;
(4)氢氧化钙和亚硫酸钠之间发生复分解反应得到亚硫酸钙和氢氧化钠,亚硫酸钙很容易被氧气氧化得到硫酸钙,氢氧化钠可以循环使用,故答案为:CaSO4;氢氧化钠溶液.
点评 本题考查学生含氮化合物、含硫化合物的性质以及应用知识,注意知识的归纳和梳理是解题的关键,难度中等.

| A. | MgCl2 | B. | Na202 | C. | K20 | D. | H202 |
| A. | 过氧化钠和氧化钠均可用作潜艇中的供氧剂 | |
| B. | 明矾可用作除去污水中悬浮颗粒的絮凝剂 | |
| C. | 氧化铝可用来制造耐火坩埚 | |
| D. | 碳酸氢钠可用作治疗胃酸过多的药物及食品发酵剂 |
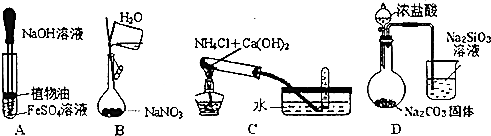
| A. | 观察Fe(OH)2的生成 | |
| B. | 配置1mol•L-1的NaNO3溶液 | |
| C. | 实验室制取氨气 | |
| D. | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
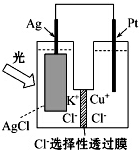 一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )| A. | 生成108g银,转移电子个数为1mol | |
| B. | Cu+在负极发生氧化反应 | |
| C. | Ag电极活泼,Ag失电子发生氧化反应 | |
| D. | Cl-由负极迁移到正极 |
| A. | 乙醛分子中最多有5个原子共平面 | B. | 苯酚分子中所有原子一定共面 | ||
| C. | 分子式为C2H6O的结构只有一种 | D. | 1,2-二溴乙稀不存在同分异构体 |
| A. | 温度130℃、压强3.03×105Pa | B. | 温度25℃、压强1.01×105Pa | ||
| C. | 温度130℃、压强5.05×105Pa | D. | 温度0℃、压强5.05×105Pa |
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(2)写出实验3中的正极反应式2H++2e-═H2↑.