题目内容
13.CuCl2、CuCl是重要的化工原料,广泛地用作有机合成催化剂.实验室中以粗铜(含杂质Fe)为原料,一种制备铜的氯化物的流程如图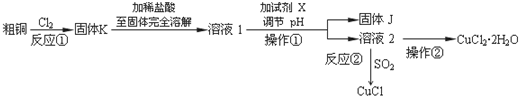
请回答下列问题:
(1)如图装置进行反应①,导管a通入氯气(夹持仪器和加热装置省略).观察到的现象是试管内有棕色烟产生,写出铜与氯气反应的化学方程式Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$CuCl2.
(2)上述流程中固体K溶于稀盐酸的目的是避免Cu2+水解
试剂X、固体J的物质分别为c.
a.NaOH Fe(OH)3 b.NH3•H2O Fe(OH)2
c.CuO Fe(OH)3 d.CuSO4 Cu(OH)2
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀.写出制备CuCl的离子方程式2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;加热\;}}{\;}$2CuCl↓+4H++SO42-.
(4)反应后,如图盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效.该红褐色沉淀的主要化学式是Fe(OH)3.该腐蚀过程的正极反应式为ClO-+2e-+H2O=Cl-+2OH-.
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,写出此过程中阴极上的电极反应式Cu2++e-+Cl-=CuCl.
分析 粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,同时抑制氯化铜、氯化铁水解,溶液1中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2•2H2O,故溶液2为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却结晶得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体.
(1)铜在氯气中燃烧产生棕色氯化铜烟;
(2)氯化铜、氯化铁在溶液中会发生水解,铜盐水解生成氢氧化铜,保持溶液呈强酸性,避免铜离子水解损失,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去;
(3)铜离子是氧化剂,SO2是还原剂,生成CuCl和SO42-;
(4)氢氧化钠溶液吸收氯气,生成有次氯酸钠,生铁在次氯酸钠和氢氧化钠的混合溶液中发生电化学腐蚀,碳等杂质为正极,铁为负极,正极发生还原反应,负极发生氧化反应,红褐色沉淀为氢氧化铁,正极上ClO-得电子生成Cl-;
(5)Cu2+在阴极上得电子,铜元素的化合价可以降至+1价、0价,部分CuCl析出是Cu2+得到电子生成CuCl,结合电荷守恒配平书写电极反应.
解答 解:粗铜(含杂质Fe)与氯气反应生成氯化铁和氯化铜,加稀盐酸溶解,形成氯化铁和氯化铜溶液,同时抑制氯化铜、氯化铁水解,溶液1中加入X调节溶液pH,得到溶液乙,经过系列操作得到CuCl2•2H2O,故溶液2为CuCl2溶液,则调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,试剂X可以为CuO、氢氧化铜等,结合题目信息可知,氯化铜溶液,加少量盐酸,抑制氯化铜水解,再蒸发浓缩、冷却结晶得到CuCl2•2H2O,再经过过滤、洗涤、干燥得到纯净的晶体.
(1)铜在氯气中燃烧生成固体氯化铜,观察到棕黄色的烟,反应为:Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$CuCl2,
故答案为:试管内有棕色烟产生;Cu+Cl2$\frac{\underline{\;点燃\;}}{\;}$CuCl2;
(2)氯化铜、氯化铁中的金属离子易水解,直接用水溶液配制溶液会产生浑浊,所以加入过量的盐酸来溶解氯化铜、氯化铁,以抑制氯化铜、氯化铁水解;用于调节pH以除去溶液1杂质可加试剂具有与酸反应,且不引入Cu2+之外的离子,故用CuO或Cu2(OH)或Cu2(OH)2CO3,调节pH目的是使溶液中铁离子转化为Fe(OH)3沉淀,过滤除去,且不能引入新杂质,
故答案为:避免Cu2+水解;c;
(3)根据信息可知:在加热条件下,SO2与铜离子反应生成CuCl白色沉淀和SO42-,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;加热\;}}{\;}$2CuCl↓+4H++SO42-,
故答案为:2Cu2++2Cl-+SO2+2H2O$\frac{\underline{\;加热\;}}{\;}$2CuCl↓+4H++SO42-;
(4)氢氧化钠溶液吸收氯气,生成有次氯酸钠,生铁在次氯酸钠和氢氧化钠的混合溶液中发生电化学腐蚀,碳等杂质为正极,铁为负极.负极的电极反应式为Fe-2e-=Fe2+,Fe2++2OH-=Fe(OH)2,4Fe(OH)2+O2+2H2O=4Fe(OH)3,正极的电极反应式为ClO-+2e-+H2O=Cl-+2OH-,红褐色沉淀为氢氧化铁,
故答案为:Fe(OH)3;ClO-+2e-+H2O=Cl-+2OH-;
(5)以石墨为电极,电解CuCl2溶液时发现阴极上也会有部分CuCl析出,阴极上是得到电子发生还原反应,Cu2+得到电子生成CuCl,电极反应为:Cu2++e-+Cl-=CuCl,故答案为:Cu2++e-+Cl-=CuCl.
点评 本题考查物质制备,涉及物质的制备实验操作、离子检验、除杂质、离子方程式的书写、原电池原理的应用等,明确基本操作原理、物质性质及化学反应原理是解本题关键,难点是电极反应式的书写,解答问题时要明确流程图中可能发生的反应或操作方法,题目难度中等.

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
| a转化为b | a转化为c | c转化为b | |
| A | NaOH | Na | CO2 |
| B | Na2CO3 | NaOH | HCl |
| C | NaHCO3 | NaOH | CO2 |
| D | NaHCO3 | Na | HCl |
| A. | A | B. | B | C. | C | D. | D |
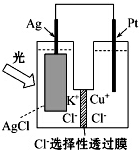 一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )| A. | 生成108g银,转移电子个数为1mol | |
| B. | Cu+在负极发生氧化反应 | |
| C. | Ag电极活泼,Ag失电子发生氧化反应 | |
| D. | Cl-由负极迁移到正极 |
| A. | 温度130℃、压强3.03×105Pa | B. | 温度25℃、压强1.01×105Pa | ||
| C. | 温度130℃、压强5.05×105Pa | D. | 温度0℃、压强5.05×105Pa |
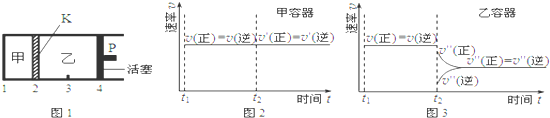
| A. | 保持活塞位置不变,降低温度,达到新的平衡后,甲、乙中B的体积分数均增大 | |
| B. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
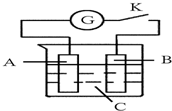 如图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是( )
如图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是( )| A. | A是Cu、B是Zn、C是CuSO4溶液 | B. | A是Cu、B是Cu、C是H2SO4溶液 | ||
| C. | A是Zn、B是石墨、C是稀H2SO4溶液 | D. | A是石墨、B是Zn、C是CuSO4溶液 |

下列有关说法不正确的是( )
| A. | 由Ⅱ可知X中一定存在SiO2 | B. | 无法判断混合物中是否含有Na2O | ||
| C. | 1.92 g固体成分为Cu | D. | 15.6 g混合物X中m(Fe2O3):m(Cu)=1:1 |
| A. | 该溶液中最多存在4种离子 | |
| B. | 该溶液中不能确定是否存在CO32- | |
| C. | 该溶液中一定存在Cl-、且c(Cl-)≥0.4mol?L-1 | |
| D. | 该溶液可由KCl、(NH4)2SO4和FeCl3配制而成 |
