题目内容
6.足量铜与200mL浓硝酸完全反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),若向所得溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是60mL,则原硝酸的物质的量浓度是多少?分析 向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,溶液中溶质为NaNO3,根据钠离子守恒可知n(NaNO3)=n(NaOH),根据N元素守恒可知n原(HNO3)=n(NaNO3)+n(NO2)+n(NO),进而计算原硝酸的物质的量浓度.
解答 解:向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,沉淀为Cu(OH)2,溶液中溶质为NaNO3,消耗NaOH溶液的体积是60mL,根据钠离子守恒可知n(NaNO3)=n(NaOH)=0.06L×5mol/L=0.3mol,根据N元素守恒可知n原(HNO3)=n(NaNO3)+n(NO2)+n(NO)=0.3mol+$\frac{2.24L}{22.4L/mol}$=0.4mol,故原硝酸的物质的量浓度为$\frac{0.4mol}{0.2L}$=2mol/L,
答:原硝酸的物质的量浓度为2mol/L.
点评 本题考查化学方程式有关计算,注意利用守恒法计算解答,避免过程的繁琐,侧重考查学生分析计算能力,难度中等.

练习册系列答案
相关题目
17.生产、生活离不开各种化学物质,下列说法不正确的是( )
| A. | 过氧化钠和氧化钠均可用作潜艇中的供氧剂 | |
| B. | 明矾可用作除去污水中悬浮颗粒的絮凝剂 | |
| C. | 氧化铝可用来制造耐火坩埚 | |
| D. | 碳酸氢钠可用作治疗胃酸过多的药物及食品发酵剂 |
14.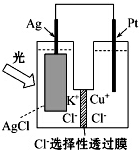 一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
 一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )| A. | 生成108g银,转移电子个数为1mol | |
| B. | Cu+在负极发生氧化反应 | |
| C. | Ag电极活泼,Ag失电子发生氧化反应 | |
| D. | Cl-由负极迁移到正极 |
1.下列关于有机物的结构的描述正确的是( )
| A. | 乙醛分子中最多有5个原子共平面 | B. | 苯酚分子中所有原子一定共面 | ||
| C. | 分子式为C2H6O的结构只有一种 | D. | 1,2-二溴乙稀不存在同分异构体 |
8.一定条件下,反应2NO2(g)?N2O4(g)△H<0,在密闭容器中达到平衡.在测定NO2的相对分子质量时,下列条件中,测定结果误差最小的是( )
| A. | 温度130℃、压强3.03×105Pa | B. | 温度25℃、压强1.01×105Pa | ||
| C. | 温度130℃、压强5.05×105Pa | D. | 温度0℃、压强5.05×105Pa |
5.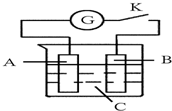 如图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是( )
如图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是( )
 如图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是( )
如图所示,把A、B插入C的溶液中,闭合电键K后电流计G的指针会发生偏转,且B上有气泡产生,则A、B、C三种物质可能是( )| A. | A是Cu、B是Zn、C是CuSO4溶液 | B. | A是Cu、B是Cu、C是H2SO4溶液 | ||
| C. | A是Zn、B是石墨、C是稀H2SO4溶液 | D. | A是石墨、B是Zn、C是CuSO4溶液 |
6.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA | |
| B. | 2.3 g钠在足量的氧气中燃烧,钠失去的电子数为0.2NA | |
| C. | 标准状况下,2g氢气所含原子数目为NA | |
| D. | 100mL0.2mol/L BaCl2溶液中Cl-的数目为0.02NA |
