题目内容
4.下列过程吸收热量的是( )| A. | 碘的升华 | B. | 天然气燃烧 | C. | 铝热反应 | D. | 钠与水反应 |
分析 A.固态直接变为气态叫做升华;
B.所有的燃烧反应都属于放热反应;
C.铝热反应属于放热反应;
D.活泼金属和水的反应是放热反应.
解答 解:A.固态直接变为气态叫做升华,碘的升华吸收热量,故A正确;
B.天然气燃烧属于放热反应,故B错误;
C.铝热反应属于放热反应,故C错误;
D.钠与水反应,放出大量的热量,故D错误;
故选A.
点评 本题考查了物质变化过程中的能量变化,难度不大,掌握常见的吸热反应和放热反应是关键,注意基础知识的积累.

练习册系列答案
相关题目
14.电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示.已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.下列叙述中正确的是( )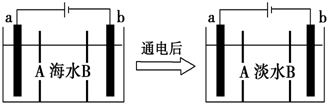

| A. | A膜是阳离子交换膜(只允许阳离子通过) | |
| B. | 通电后,海水中阴离子往b电极处运动 | |
| C. | 通电后,a电极的电极反应为4OH-4e-═O2↑+2H2O | |
| D. | 通电后,b电极上产生无色气体,溶液中出现少量白色沉淀 |
12.研究SO2、NOX、CO等大气污染气体的处理及利用的方法具有重要意义.
(1)火力发电厂的燃煤排烟中含大量的氮氧化物(NOX),可利用甲烷和NOX在一定条件下反应消除其污染.已知:
①N2(g)+O2(g)═2NO(g);△H1=180.5kJ•mol-1
②2NO(g)+O2(g)═2NO2(g);△H2=-113.0kJ•mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H3=-889.5kJ•mol-1
则NO2与CH4转化成N2和H2O(l)的热化学方程式为2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l)△H=-957kJ•mol-1.
(2)用活性炭还原法也可以处理氮氧化物,有关反应为C(s)+2NO(g)?N2(g)+CO2(g).一定温度下密闭容器中反应有关数据如下表:
①判断该反应达到平衡状态的标志是abd(填字母).
a.v正(NO)=2v逆(N2)
b.N2的浓度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
②若平衡后升高温度 ,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).
,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).
(3)利用如图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2.
①a为电源的正极(填“正极”或“负极”),阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO42-生成.该反应中氧化剂与还原剂的物质的量之比为1:2.
(1)火力发电厂的燃煤排烟中含大量的氮氧化物(NOX),可利用甲烷和NOX在一定条件下反应消除其污染.已知:
①N2(g)+O2(g)═2NO(g);△H1=180.5kJ•mol-1
②2NO(g)+O2(g)═2NO2(g);△H2=-113.0kJ•mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H3=-889.5kJ•mol-1
则NO2与CH4转化成N2和H2O(l)的热化学方程式为2NO2(g)+CH4(g)=N2(g)+CO2(g)+2H2O(l)△H=-957kJ•mol-1.
(2)用活性炭还原法也可以处理氮氧化物,有关反应为C(s)+2NO(g)?N2(g)+CO2(g).一定温度下密闭容器中反应有关数据如下表:
| NO | N2 | CO2 | |
| 起始浓度/mol•L-1 | 0.10 | 0 | 0 |
| 平衡浓度/mol•L-1 | 0.04 | 0.03 | 0.03 |
a.v正(NO)=2v逆(N2)
b.N2的浓度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
②若平衡后升高温度
 ,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).
,再次达到平衡测得容器中NO、N2、CO2的浓度值比为5:3:3,则△H<0(填“>”、“=”或“<”).(3)利用如图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2.
①a为电源的正极(填“正极”或“负极”),阳极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO42-生成.该反应中氧化剂与还原剂的物质的量之比为1:2.
19.下列物质属于含有共价键的离子化合物的是( )
| A. | MgCl2 | B. | Na202 | C. | K20 | D. | H202 |
9. 2015年9月25日,我国自主研制的长征-11固体火箭成功首飞.某些固体火箭燃料中含有铝粉和硝酸钾,两者高温点火时可以发生氧化还原反应.关于该反应,下列说法正确的是( )
2015年9月25日,我国自主研制的长征-11固体火箭成功首飞.某些固体火箭燃料中含有铝粉和硝酸钾,两者高温点火时可以发生氧化还原反应.关于该反应,下列说法正确的是( )
 2015年9月25日,我国自主研制的长征-11固体火箭成功首飞.某些固体火箭燃料中含有铝粉和硝酸钾,两者高温点火时可以发生氧化还原反应.关于该反应,下列说法正确的是( )
2015年9月25日,我国自主研制的长征-11固体火箭成功首飞.某些固体火箭燃料中含有铝粉和硝酸钾,两者高温点火时可以发生氧化还原反应.关于该反应,下列说法正确的是( )| A. | Al粉作为氧化剂 | B. | Al被氧化 | C. | Al发生还原反应 | D. | Al得到电子 |
13.有下列三种有机物,实现它们之间相互转化所选试剂(均足量)正确的是( )


| a转化为b | a转化为c | c转化为b | |
| A | NaOH | Na | CO2 |
| B | Na2CO3 | NaOH | HCl |
| C | NaHCO3 | NaOH | CO2 |
| D | NaHCO3 | Na | HCl |
| A. | A | B. | B | C. | C | D. | D |
14.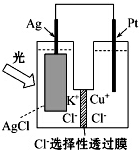 一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
 一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )
一种光化学的结构如图所示,电池总反应为AgCl(s)+Cu+(aq)═Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是( )| A. | 生成108g银,转移电子个数为1mol | |
| B. | Cu+在负极发生氧化反应 | |
| C. | Ag电极活泼,Ag失电子发生氧化反应 | |
| D. | Cl-由负极迁移到正极 |