题目内容
19.下列推断合理的是( )| A. | 明矾在水中能形成Al(OH)3胶体,可用作净水剂 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 漂白粉、盐酸、碘酒和液氯都属于混合物 | |
| D. | 将SO2通人品红溶液,溶液褪色后加热恢复原色;将SO2通人溴水,溴水褪色后加热也能恢复原色 |
分析 A、明矾在水中电离出铝离子,铝离子水解生成Al(OH)3胶体;
B、金刚石的成分是碳,能在氧气中燃烧;
C、液氯是液态的氯气;
D、二氧化硫和溴水的反应为氧化还原反应.
解答 解:A、明矾在水中电离出铝离子,铝离子水解生成Al(OH)3胶体,Al(OH)3胶体能吸附水中的悬浮颗粒,故A正确;
B、金刚石的成分是碳,能在氧气中燃烧生成二氧化碳,故B错误;
C、液氯是液态的氯气,是纯净物,而漂白粉、盐酸和碘酒是混合物,故C错误;
D、SO2通入溴水后发生氧化还原反应,SO2+Br2+2H2O=H2SO4+2HBr,则将SO2通入溴水,溴水褪色后加热不能恢复原色,故D错误;
故选A.
点评 本题虽然简单,但是从多方面考查了元素化合物及胶体性质,覆盖面广,是一好题.

练习册系列答案
相关题目
9.用下列装置能达到有关实验目的是( )


| A. | 图1装置可以用来电解制氢气和氯气 | |
| B. | 图2装置可以完成“喷泉”实验 | |
| C. | 图3装置可以用来实验室制氯气 | |
| D. | 图4装置可以用来配制一定物质的量浓度的氯化钠溶液 |
10.下列离子的检验方法和结论正确的是( )
| A. | 向某溶液中滴加几滴双氧水后再滴加2滴KSCN溶液,溶液变成血红色,则原溶液中一定含有Fe2+ | |
| B. | 向某溶液中加入盐酸酸化的氯化钡溶液,产生白色沉淀,则原溶液中一定含有SO42- | |
| C. | 向某溶液中加入稀盐酸产生无色气体,产生的气体使澄清石灰水变浑浊,则原溶液中一定有CO32- | |
| D. | 向某溶液中滴加NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液中一定含 有NH4+ |
7. 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),该电池放电时总反应为:NiOOH+MH═Ni(OH)2+M,下列有关说法中不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),该电池放电时总反应为:NiOOH+MH═Ni(OH)2+M,下列有关说法中不正确的是( )
 如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),该电池放电时总反应为:NiOOH+MH═Ni(OH)2+M,下列有关说法中不正确的是( )
如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH-Ni电池),该电池放电时总反应为:NiOOH+MH═Ni(OH)2+M,下列有关说法中不正确的是( )| A. | 放电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 电池的电解液可为KOH溶液 | |
| C. | 充电时负极反应为:MH+OH-+e-═H2O+M | |
| D. | MH是一类储氢材料,其氢密度越大,电池的能量密度越高 |
14.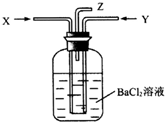 碳跟浓硫酸共热产生的混合气体X(CO2、SO2)和铜跟过量浓硝酸反应产生的气体Y(NO2)同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
碳跟浓硫酸共热产生的混合气体X(CO2、SO2)和铜跟过量浓硝酸反应产生的气体Y(NO2)同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
 碳跟浓硫酸共热产生的混合气体X(CO2、SO2)和铜跟过量浓硝酸反应产生的气体Y(NO2)同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
碳跟浓硫酸共热产生的混合气体X(CO2、SO2)和铜跟过量浓硝酸反应产生的气体Y(NO2)同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )| A. | 洗气瓶中产生的沉淀是碳酸钡 | B. | 在Z导管出来的气体中无二氧化碳 | ||
| C. | 在Z导管口不会出现红棕色气体 | D. | 洗气瓶中产生的沉淀是硫酸钡 |
4. 维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.
维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.
(1)测定目的:测定某品牌软包装橙汁中维生素C的含量.
(2)测定原理:C6H8O6+I2→C6H6O6+2H++2I-.
(3)实验用品:①仪器:(自选,略).
试剂:指示剂淀粉溶液(填名称)、浓度为7.5×10-3 mol•L-1的标准碘溶液、蒸馏水等.
(4)实验过程:
①洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用.
②打开橙汁包装,目测:颜色--橙黄色,澄清度--好.用酸式滴定管(或移液管)(填仪器名称)向锥形瓶中量入20.00mL待测橙汁,滴入2滴指示剂.
③用左手控制滴定管的活塞(填部位),右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化,直到滴定终点,滴定至终点的现象是最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色.
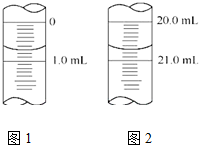
(5)数据记录与处理:如图1为某一次滴定管滴定前液面,其读数值为0.70mL图2为滴定结束液面,则本次滴定过程共使用了20.00mL标准碘溶液
几次滴定消耗NaOH溶液的体积如下:
则此橙汁中维生素C的含量是1320mg•L-1.
(6)问题讨论:取标准碘溶液的滴定管洗涤之后直接装液开始滴定,则测定结果偏高.(填“偏高”、“偏低”、“无影响”)
 维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.
维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.(1)测定目的:测定某品牌软包装橙汁中维生素C的含量.
(2)测定原理:C6H8O6+I2→C6H6O6+2H++2I-.
(3)实验用品:①仪器:(自选,略).
试剂:指示剂淀粉溶液(填名称)、浓度为7.5×10-3 mol•L-1的标准碘溶液、蒸馏水等.
(4)实验过程:
①洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用.
②打开橙汁包装,目测:颜色--橙黄色,澄清度--好.用酸式滴定管(或移液管)(填仪器名称)向锥形瓶中量入20.00mL待测橙汁,滴入2滴指示剂.
③用左手控制滴定管的活塞(填部位),右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化,直到滴定终点,滴定至终点的现象是最后一滴标准液滴入,溶液由无色变为蓝色,且半分钟不褪色.
(5)数据记录与处理:如图1为某一次滴定管滴定前液面,其读数值为0.70mL图2为滴定结束液面,则本次滴定过程共使用了20.00mL标准碘溶液
几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
(6)问题讨论:取标准碘溶液的滴定管洗涤之后直接装液开始滴定,则测定结果偏高.(填“偏高”、“偏低”、“无影响”)
11.自然环境与人们的生活息息相关.下列有关说法中,不正确的是( )
| A. | 废旧显示器必须回收,其主要目的是为了提取其中的贵重金属 | |
| B. | 生活污水中所含的氮、磷化合物是植物营养素,但会导致水体污染 | |
| C. | 二氧化碳和甲烷等会导致“温室效应”,从而引起全球变暖 | |
| D. | 雾霾天气会造成严重的交通问题,雾霾是一种胶体 |
8.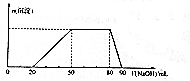 某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )
某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )
 某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )
某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )| A. | 原溶液中一定存在Mg2+、Al3+、H+、SO42- | |
| B. | 原溶液中Al3+的浓度为1mol•L-1 | |
| C. | 原溶液中NH4+的物质的量为0.4mol | |
| D. | 当加入的NaOH的溶液的体积为90mL时,反应后溶液中的离子只有Na+和SO42- |
9.下列各种叙述正确的是( )
| A. | 两种粒子,若核外电子排布完全相同,则其化学性质一定相同 | |
| B. | 离子化合物中,一定存在金属元素和非金属元素 | |
| C. | 同时含有离子键和共价键的化合物,一定是离子化合物,不可能是共价化合物 | |
| D. | 难失电子的原子,获得电子的能力一定强 |