题目内容
12.在水中加入等物质的量的Ag+、Ba2+、Na+、SO42-、NO3-、Cl-.该溶液放在用惰性材料作电极的电解槽中,通电片刻,则氧化产物和还原产物的质量比为( )| A. | 35.5:108 | B. | 16:137 | C. | 8:1 | D. | 108:35.5 |
分析 等物质的量的这些离子加入到水中,Ag+和Cl-沉淀为AgCl,Bb 2+ 和SO4 2-沉淀为BbSO4,溶液中就只有Na+、NO3-,实际上的电解NaNO3溶液,阳极上氢氧根离子放电,阴极上氢离子放电,则氧化产物是氧气,还原产物是氢气.
解答 解:等物质的量的这些离子加入到水中,Ag+和Cl-沉淀为AgCl,Bb 2+ 和SO4 2-沉淀为BbSO4,溶液中就只有Na+、NO3-,实际上的电解NaNO3溶液,阳极上氢氧根离子放电产物是氧气,阴极上氢离子放电产物是氢气,
依据化学方程式2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,当转移相同电子时,阳极产物与阴极产物质量32:(2×2)=8:1,
故选C.
点评 本题考查了离子共存和电解池原理,明确实际上电解的物质是解本题关键,注意把握离子之间的沉淀反应,属于易错题,题目难度中等.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
20.设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 80mL 10mol•L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA | |
| B. | 2 L0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| D. | 标准状况下,11.2LSO3所含的分子数大于0.5NA |
17.下列反应中符合图象的是( )
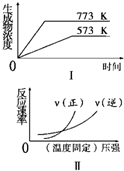

| A. | N2(g)+3H2(g)?2NH3(g)△H<0 | B. | 2SO3(g)?2SO2 (g)+O2(g)△H>0 | ||
| C. | 4NH3(g)+5O2 (g)?4NO(g)+6H2O(g)△H<0 | D. | H2(g)+CO(g)?C(s)+H2O(g)△H>0 |
2.只给出下列甲中和乙中对应的量,不能组成一个求物质的量公式的是( )
| 选项 | 甲 | 乙 |
| A | 物质的粒子数 | 阿伏加德罗常数 |
| B | 标况下气体的体积 | 标况下气体摩尔体积 |
| C | 固体的体积 | 固体的密度 |
| D | 溶液的物质的量浓度 | 溶液的体积 |


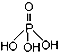 ),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:
),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空: