题目内容
3.CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.I、甲醇可以补充和部分替代石油燃料,缓解能源紧张.利用CO可以合成甲醇.
(1)已知:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-283.0kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(I)△H2=-285.8kJ•mol-1
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(I)△H3=-764.5kJ•mol-1
则CO(g)+2H2(g)═CH3OH(g)△H=-90.1kJ•mol-1
(2)一定条件下,在容积为VL的密闭容器中充入α mol CO与2a mol H2合成甲醇
平衡转化率与温度、压强的关系如图1所示.

①P1< P2(填“>”、“<”或“=”),理由是甲醇的合成反应是气体分子数减少的反应,相同温度下,增大压强CO的转化率提高
②该甲醇合成反应在A点的平衡常数K=$\frac{12{V}^{2}}{{a}^{2}}$(用a和V表示)
③该反应达到平衡时,反应物转化率的关系是:CO=H2(填“>”、“<”或“=”)
④下列措施中能够同时满足增大反应速率和提高CO转化率的是c.(填写相应字母)
a、使用高效催化剂 b、降低反应温度 c、增大体系压强
d、不断将CH30H从反应混合物中分离出来 e、增加等物质的量的CO和H2
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸.
(3)原电池法:
该小组设计的原电池原理如图2所示,写出该电池负极的电极反应式SO2-2e-+2H2O═SO42-+4H+.
(4)电解法:
该小组用Na2SO3溶液充分吸收S02得到NaHSO3溶液,然后电解该溶液制得了硫酸.原理如图3所示.写出开始电解时阳极的电极反应式HSO3-+H2O-2e-=SO42-+3H+.
分析 (1)已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-283.0kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(I)△H2=-285.8kJ•mol-1
③CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(I)△H3=-764.5kJ•mol-1
根据盖斯定律,①+2×②-③得:CO(g)+2H2(g)═CH3OH(g),△H=△H1+2△H2-△H3;
(2)①由图象可知,相同温度下,P2压强下一氧化碳转化率大于P1压强下的转化率,正反应是气体体积减小的反应,压强增大平衡正向进行,CO转化率增大;
②A点CO的转化率为0.75,则转化的CO为0.75a mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):a 2a 0
变化量(mol):0.75a 1.5a 0.75a
平衡量(mol):0.25a 0.5a 0.75a
再根据平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算;
③CO和H2按照物质的量比1:2反应,而开始充入a molCO与2a molH2也刚好为1:2,所以CO的转化率等于H2的转化率;
④a.使用高效催化剂不影响平衡移动;
b.降低反应温度会减慢反应速率;
c.增大体系压强,增大反应速率,而且平衡也向正反应方向移动;
d.不断将CH3OH从反应混合物中分离出来,即减小生成物的浓度,则反应速率减小;
e.增加等物质的量的CO和H2,即增大反应物的浓度,反应速率增大,但CO的转化率减小;
(3)负极发生氧化反应,由图可知,负极上是二氧化硫氧化生成硫酸;
(4)阳极发生氧化反应,电解开始是HSO3-失去电子被氧化生成SO42-.
解答 解:(1)(1)已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-283.0kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(I)△H2=-285.8kJ•mol-1
③CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(I)△H3=-764.5kJ•mol-1
根据盖斯定律,①+2×②-③得:CO(g)+2H2(g)═CH3OH(g),△H=△H1+2△H2-△H3=(-283.0-285.8×2+764.5)kJ•mol-1=-90.1kJ•mol-1,
故答案为:-90.1;
(2)①由图象可知,相同温度下,P2压强下一氧化碳转化率大于P1压强下的转化率,甲醇的合成反应是气体分子数减少的反应,相同温度下,增大压强CO的转化率提高,所以P1<P2,
故答案为:<;甲醇的合成反应是气体分子数减少的反应,相同温度下,增大压强CO的转化率提高;
②A点CO的转化率为0.75,则转化的CO为0.75a mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):a 2a 0
变化量(mol):0.75a 1.5a 0.75a
平衡量(mol):0.25a 0.5a 0.75a
则平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{0.75a}{V}}{\frac{0.25a}{V}×(\frac{0.5a}{V})^{2}}$=$\frac{12{V}^{2}}{{a}^{2}}$,
故答案为:$\frac{12{V}^{2}}{{a}^{2}}$;
③CO和H2按照物质的量比1:2反应,而开始充入a molCO与2a molH2也刚好为1:2,所以CO的转化率等于H2的转化率,
故答案为:=;
④a.使用高效催化剂加快反应速率,但不影响平衡移动,CO转化率不变,故a错误;
b.降低反应温度平衡正向移动,CO转化率增大,但会减慢反应速率,故b错误;
c.增大体系压强,增大反应速率,而且平衡也向正反应方向移动,CO转化率增大,故c正确;
d.不断将CH3OH从反应混合物中分离出来,平衡正向移动,CO转化率增大,但减小生成物的浓度,反应速率减小,故d错误
e.增加等物质的量的CO和H2,即增大反应物的浓度,反应速率增大,但CO的转化率减小,故e错误,
故选:c;
(3)负极发生氧化反应,由图可知,负极上是二氧化硫氧化生成硫酸,负极电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
(4)阳极发生氧化反应,电解开始是HSO3-失去电子被氧化生成SO42-,阳极电极反应式为:HSO3-+H2O-2e-=SO42-+3H+,
故答案为:HSO3-+H2O-2e-=SO42-+3H+.
点评 本题考查化学平衡计算、化学平衡影响因素、反应热计算、电极反应式书写等,较好的考查学生分析能力、知识运用与获取信息的能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 0.5mol | B. | 0.7mol | C. | 0.8mol | D. | 0.9mol |
(1)工业上可用CO2和H2反应合成甲醇,已知25℃、101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242kJ•mol-1
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O△H2=-676kJ•mol-1
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
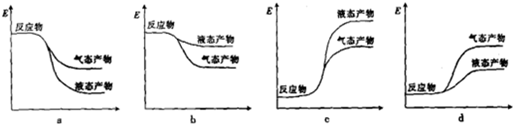
②下列表示合成甲醇反应的能量变化示意图中正确的是a(填字母).
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•l-1,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2?CH3OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol•L-1)变化如下表所示(前6min没有改变条件):
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性高;
Ⅱ.温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL0.1000mol•L-1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH>(填“<”“>”或“=”)7,原因是HCOO-+H2O?+HCOOH+OH-(用离子方程式表示).
| A. | 弱电解质的电离是一个吸热过程,升温其电离度增大 | |
| B. | 某些盐类的水解是一个吸热过程,升温水解程度增大 | |
| C. | 溶液的酸碱性取决于溶液中氢离子浓度的大小 | |
| D. | 酸性溶液不一定是酸溶液,碱性溶液不一定是碱溶液 |
| A. | 电能是二级能源 | B. | 水力是二级能源 | ||
| C. | 天然气是二级能源 | D. | 焦炉气是一级能源 |
| A. | 35.5:108 | B. | 16:137 | C. | 8:1 | D. | 108:35.5 |

| A. | 用装置甲制取二氧化硫气体 | |
| B. | 用装置乙收集二氧化硫气体 | |
| C. | 用适量CuO粉末中和反应后溶液,用装置丙过滤 | |
| D. | 用装置丁蒸发浓缩CuSO4溶液 |
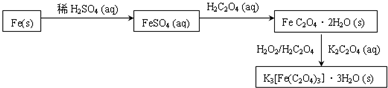
 苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下:
苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2+H2O
+KOH+2MnO2+H2O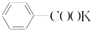 +HCl→
+HCl→ +KCl
+KCl