题目内容
2.用含少量铁的氧化铜为原料制取氯化铜晶体(CuCl2•xH2O)的主要流程如下:
已知有关金属离子的氢氧化物从开始沉淀到沉淀完全时溶液的pH数据为:
Fe3+:2.7-3.7;CU2+:5.2-6.4;Fe2+:7.6-9.6
请回答下列问题:
(1)原料经酸溶所得到的pH=2的混合液中含有的金属离子主要有Cu2+、Fe2+.(写离子符号)
(2)使用氧化剂A的目的是将Fe2+氧化为Fe3+.A可选下列物质中的①.(填序号)
①Cl2 ②KMnO4 ③HNO3
(3)试剂B的作用是调节溶液的PH至3.7~5.2,使Fe3+完全沉淀.滤渣的主要成分除可能含有B外,还一定含有的物质是Fe(OH)3.(写化学式)
(4)过滤所得到的滤液必须呈较强的酸性(即含有一定量的盐酸,必要时可以使用盐酸进行酸化),其主要目的是防止Cu2+在蒸发结晶时水解.从滤液中得到氯化铜晶体的实验操作方法依次是蒸发浓缩、冷却结晶、过滤、干燥.
分析 向含少量铁的氧化铜固体中加入盐酸,盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+=Fe2++H2↑;CuO+2H+=Cu2++H2O,加入氧化剂A的目的是把亚铁离子氧化,根据除杂原则,不能引入新的杂质;试剂B应为调节溶液pH值,使Fe3+转化为Fe(OH)3,除去Fe3+,过滤除去沉淀,对滤液进行蒸发浓缩、冷却结晶、过滤得到氯化铜晶体.
(1)原料经酸溶所得金属离子主要有:Cu2+、Fe2+;
(2)加入氧化剂,将Fe2+氧化为Fe3+,易除去,注意不能引入新的杂质;
(3)加入盐酸时,盐酸是过量的,导致溶液酸性较强,溶液酸性较强则铁离子不沉淀,为使铁离子沉淀则应提高溶液的pH,所以加入试剂B,形成Fe(OH)3沉淀,除去Fe3+;
(4)CuCl2为强酸弱碱盐,水解呈酸性,含有一定量的盐酸,可抑制其水解,从滤液经过结晶得到氯化铜晶体,首先要加热蒸发浓缩,冷却后,再将之过滤即可.
解答 解:(1)盐酸和铁、氧化铜反应,发生的离子反应方程式为:Fe+2H+=Fe2++H2↑;CuO+2H+=Cu2++H2O,所以原料经酸溶所得到的pH=2的混合液中含有的金属离子主要有:Cu2+、Fe2+,
故答案为:Cu2+、Fe2+;
(2)Fe3+从pH=2.7开始沉淀,在pH=3.7沉淀完全,Cu2+从pH=5.2开始沉淀,Fe2+从pH=7.6开始沉淀,为了除去铁杂质,需将Fe2+氧化为Fe3+,加入氧化剂A的目的是把亚铁离子氧化,①Cl2 ②KMnO4 ③HNO3,都能氧化亚铁离子,但②KMnO4 ③HNO3,均会引入杂质离子,所以选择①Cl2 ,
故答案为:将Fe2+氧化为Fe3+;①;
(3)加入试剂B的目的是调节pH使铁离子生成氢氧化铁沉淀,过滤除去沉淀,Fe3+从pH=2.7开始沉淀,在pH=3.7沉淀完全,Cu2+从pH=5.2开始沉淀,所以应该可知pH范围为3.7~5.2,使Fe3+转化为Fe(OH)3,除去Fe3+,所以滤渣的主要成分除可能含有B外,还一定含有的物质是Fe(OH)3,
故答案为:调节溶液的PH至3.7~5.2,使Fe3+完全沉淀;Fe(OH)3;
(4)CuCl2为强酸弱碱盐,会发生水解CuCl2+2H2O?Cu(OH)2+2HCl,过滤所得到的滤液必须呈较强的酸性(即含有一定量的盐酸)可抑制铜离子的水解,含有结晶水的晶体采用冷却结晶,所以从滤液中得到氯化铜晶体的实验操作方法依次为蒸发浓缩,冷却结晶、过滤、洗涤等,
故答案为:防止Cu2+在蒸发结晶时水解;蒸发浓缩;过滤.
点评 本题考查了氯化铜晶体(CuCl2•xH2O)的实验室制取,涉及物质的分离与提纯、盐类的水解以及对工艺流程理解与实验方案的设计等,题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握.

| A. | 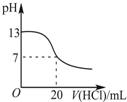 表示25℃时,用0.1mol•L-1盐酸滴定20mL 0.1mol•L-1氨水 | |
| B. | 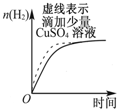 表示常温下,等量锌粉分别与两份足量的等体积等浓度的盐酸反应 | |
| C. | 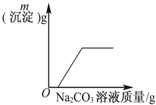 表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 | |
| D. |  表示向盐酸溶液中滴入氨水 |
| A. | 0.5mol | B. | 0.7mol | C. | 0.8mol | D. | 0.9mol |
| A. | 反应①、②、③都是氧化还原反应 | |
| B. | 反应①中H2O2被还原 | |
| C. | 氧化性:KMnO4>O2 | |
| D. | 每生成1mol F2,上述反应共转移2mol电子 |
| A. | 35.5:108 | B. | 16:137 | C. | 8:1 | D. | 108:35.5 |

 苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下:
苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2+H2O
+KOH+2MnO2+H2O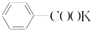 +HCl→
+HCl→ +KCl
+KCl